Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Серная кислота Презентация
Содержание
- 1. Серная кислота Презентация
- 2. Строение молекулы серной кислоты.
- 3. Слайд 3
- 4. Разбавление серной кислоты. При растворении её
- 5. FeS2SH2SSO2 → SO3 → H2SO4 ПиритСерный колчедан Получение серной кислоты.
- 6. I. Химические свойства разбавленной серной кислоты.1. Диссоциация:
- 7. 2. Взаимодействие с металлами ( до Н
- 8. 3. Взаимодействие с оcновными и амфотерными оксидами.MqO
- 9. 4. Взаимодействие с основаниями и амфотерными гидроксидами2KOH
- 10. 5.Взаимодействие с солями. Na2CO3 + H2SO4 =
- 11. Качественная реакция на серную кислоту и её
- 12. Свойства концентрированной серной кислоты.Органические вещества обугливаются !!!C12H22O11 (сахароза) → 12С (уголь) С+2H2So4=CO2+2SO2+2H2O
- 13. Концентрированная серная кислота окисляет неметаллы.неМе +
- 14. Концентрированная серная кислота окисляет металлы.концентрированная H2SO4
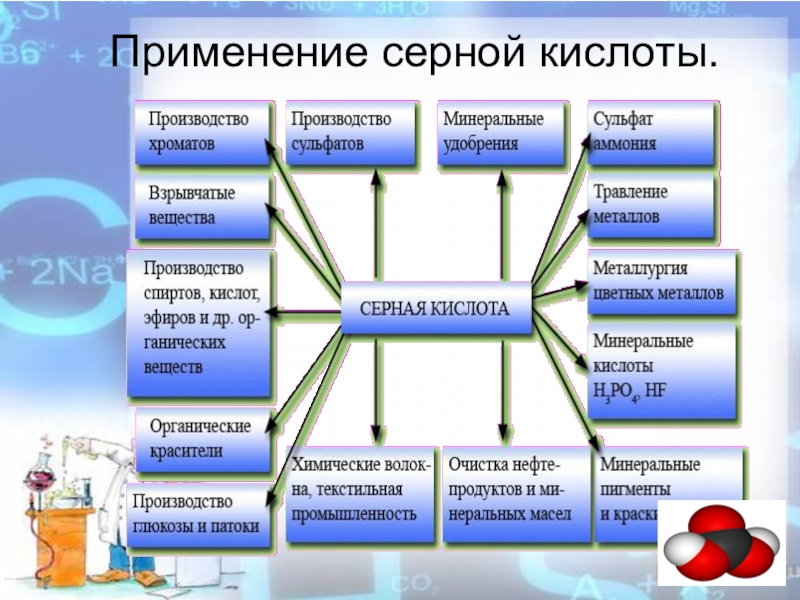
- 15. Применение серной кислоты.
- 16. Скачать презентанцию
Строение молекулы серной кислоты.
Слайды и текст этой презентации
Слайд 1МАОУ СОШ № 33 г. Тюмень
СЕРНАЯ КИСЛОТА
Подготовила: учитель химии
Аптрашитова С.А
МАОУ СОШ № 33 г.Тюмень
Слайд 3 Физические свойства.
Серная кислота
Н2SO4— бесцветная, маслянистая жидкость, без цвета и запаха. Плотность серной
кислоты 1,83 г /мл.
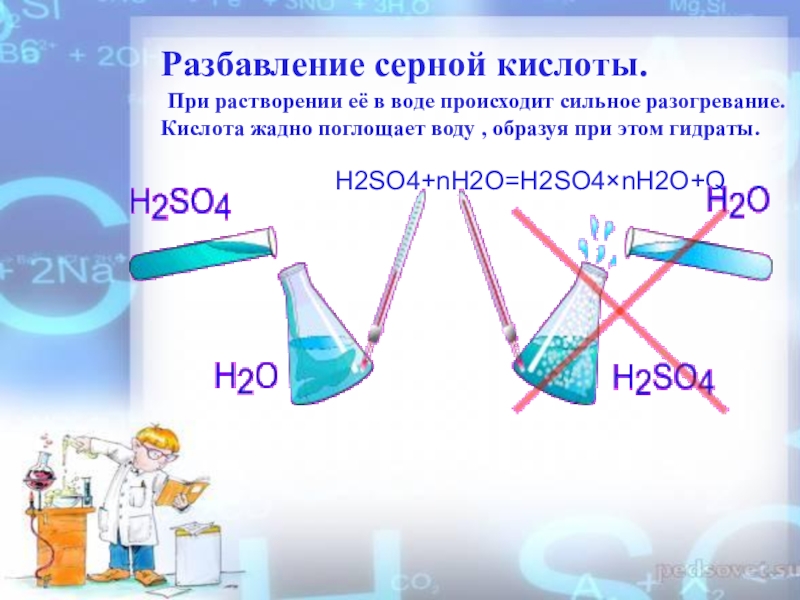
Слайд 4Разбавление серной кислоты. При растворении её в воде происходит сильное
разогревание.
Кислота жадно поглощает воду , образуя при этом гидраты.
H2SO4+nH2O=H2SO4×nH2O+QСлайд 6I. Химические свойства разбавленной серной кислоты.
1. Диссоциация:
H2SO4→ H+ + HSO4-
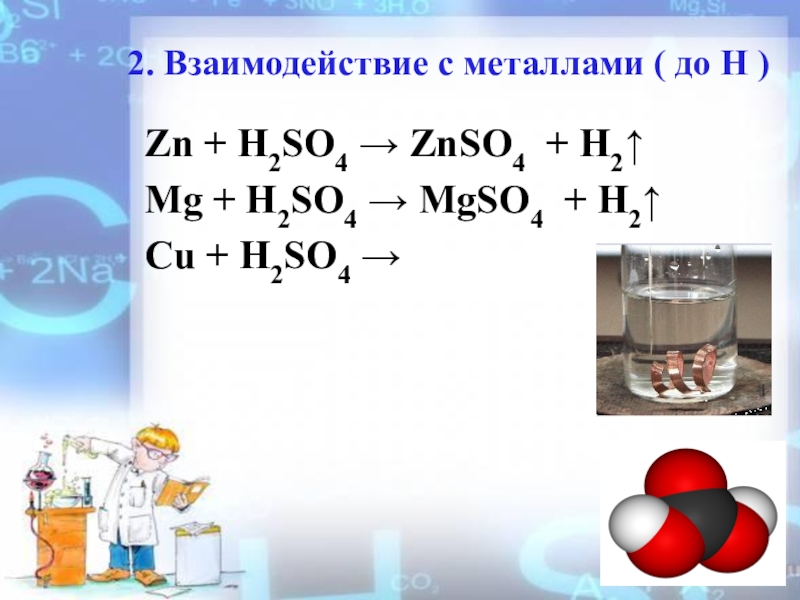
HSO4- ↔ H+ + SO42-Слайд 72. Взаимодействие с металлами ( до Н )
Zn + H2SO4
→ ZnSO4 + H2↑
Mg + H2SO4 → MgSO4 + H2↑
Cu
+ H2SO4 → Слайд 83. Взаимодействие с оcновными и амфотерными оксидами.
MqO + H2SO4 →
MqSO4 + H2O
MqO + 2H+ → Mq2+ + H2O
Al2O3 +3
H2SO4 → Al2(SO4)3 +3 H2OAl2O3 + 6H+ →2Al3+ + 3H2O
Слайд 94. Взаимодействие с основаниями и амфотерными гидроксидами
2KOH + H2SO4 →
K2SO4 +2 H2O
H+ + ОН- → H2O
KOH +
H2SO4 → KHSO4 +H2O
Кислая соль- гидросульфат натрия2Al(OH)3 + 3H2SO4 → Al2(SO4)3 +6H2O
Al(OH)3 + 3H+ → Al3+ +3H2O
Слайд 11Качественная реакция на серную кислоту и её соли.
H2SO4+BaCI2 = BaSO4
↓ + 2HCI
Ba2+ + SO42- = BaSO4↓
Слайд 12Свойства концентрированной серной кислоты.
Органические вещества обугливаются !!!
C12H22O11 (сахароза) → 12С
(уголь)
С+2H2So4=CO2+2SO2+2H2O
Слайд 13 Концентрированная серная кислота окисляет неметаллы.
неМе + H2SO4(конц.) = H2O
+ SO2 + кислородсодержащая кислота неМе,
C + 2H2SO4 =
2H2O + CO2 + 2SO2S + 2H2SO4 = 3SO2 + 2H2O
2P + 5H2SO4 = 2H3PO4 + 5SO2 + 2H2O
Слайд 14 Концентрированная серная кислота окисляет металлы.
концентрированная H2SO4 – сильный окислитель;
при взаимодействии с металлами (кроме Au, Pt) может восстанавливаться до
SO2, S или H2S (без нагревания не реагируют также Fe, Al, Cr - пассивируются):2Ag + 2H2SO4 → Ag2SO4 + SO2+ 2H2O
4Zn+5H2SO4=4ZnSO4+H2S+4H2O
3Zn+4H2SO4=3ZnSO4+S+4H2O