Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Щелочноземельные металлы
Содержание
- 1. Щелочноземельные металлы
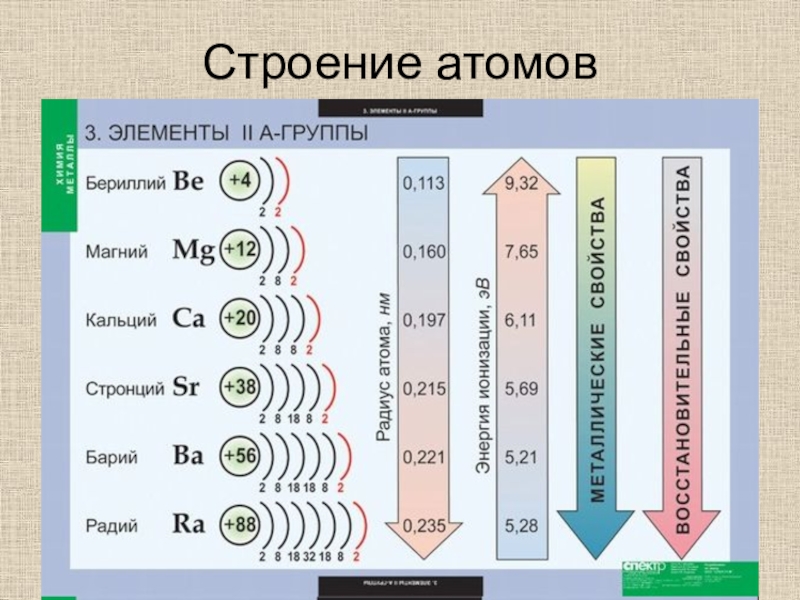
- 2. Строение атомовОбщая электронная формула ns2Валентность IIСтепень окисления +2Восстановительные свойстваМенее реакционно-способны, чем щелочные металлы
- 3. Строение атомов
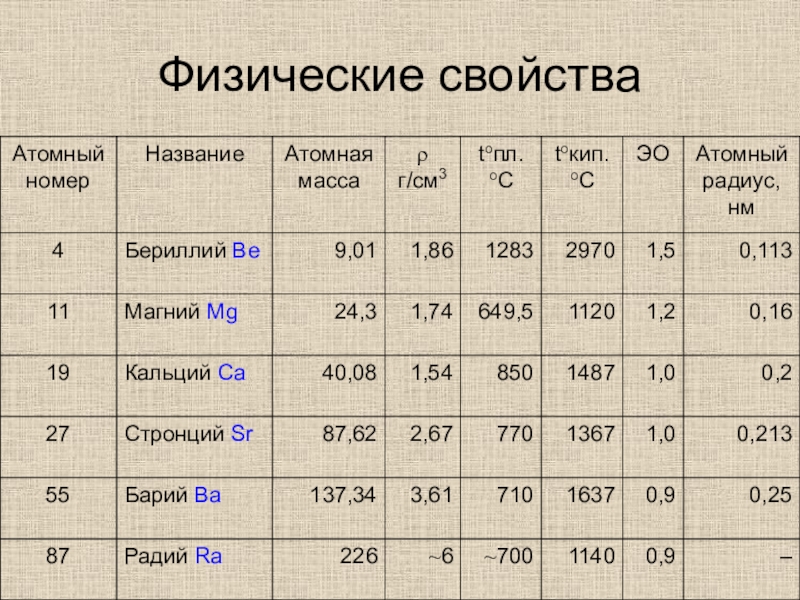
- 4. Физические свойства
- 5. Физические свойствасеребристо-белые блестящие металлы, твердость значительно выше, чем у щелочных металлов.
- 6. Be3BeO • Al2O3 • 6SiO2 – берилл
- 7. Mg MgCO3 – магнезитCaCO3 • MgCO3 –
- 8. CaCaCO3 – кальцит (известняк, мрамор и др.)Ca3(PO4)2
- 9. SrSO4 – целестинSrCO3 – стронцианитBaSO4 – баритBaCO3
- 10. Химические свойства1. Все металлы образуют оксиды RO,
- 11. Химические свойства3. Растворяются в кислотах: Me +2HCl
- 12. Качественная реакция на катионы щелочноземельных металлов –
- 13. Слайд 13
- 14. Проверка знаний Сравните атомы
- 15. Допишите уравнения реакций:
- 16. Скачать презентанцию
Строение атомовОбщая электронная формула ns2Валентность IIСтепень окисления +2Восстановительные свойстваМенее реакционно-способны, чем щелочные металлы
Слайды и текст этой презентации
Слайд 2Строение атомов
Общая электронная формула ns2
Валентность II
Степень окисления +2
Восстановительные свойства
Менее реакционно-способны,
чем щелочные металлы
Слайд 5Физические свойства
серебристо-белые блестящие металлы, твердость значительно выше, чем у щелочных
металлов.
Слайд 7Mg
MgCO3 – магнезит
CaCO3 • MgCO3 – доломит
KCl • MgSO4 •
3H2O – каинит
KCl • MgCl2 • 6H2O – карналлит
Слайд 8Ca
CaCO3 – кальцит
(известняк, мрамор и др.)
Ca3(PO4)2 – апатит, фосфорит
CaSO4
• 2H2O – гипс
CaSO4 – ангидрит
CaF2 – плавиковый шпат
(флюорит)
Слайд 9
SrSO4 – целестин
SrCO3 – стронцианит
BaSO4 – барит
BaCO3 – витерит
во всём
мире удалось
добыть всего 1,5 кг
чистого радия
Sr, Ba и Ra
Слайд 10Химические свойства
1. Все металлы образуют оксиды RO, барий-пероксид – BaO2
2Me +O2 → 2MeO
2. Бериллий и магний
сравнительно медленно реагируют с неметалламиMe +H2 → MeH2
Me +Cl2 → MeCl2
Me +S → MeS
Слайд 11Химические свойства
3. Растворяются в кислотах:
Me +2HCl → MeCl2
+ H2
Бериллий растворяется в водных растворах щелочей
4. В
обычных условиях поверхность Be и Mg покрыта инертной оксидной пленкой, поэтому они устойчивы по отношению к воде. Ca, Sr и Ba растворяются в воде с образованием гидроксидов Me +2HOH → Me(OH)2 +Н2
Слайд 12Качественная реакция на катионы щелочноземельных металлов – окрашивание пламени в
следующие цвета:
Ca2+ - темно-оранжевый
Sr2+- темно-красный
Ba2+ - светло-зеленый
Слайд 14Проверка знаний
Сравните атомы элементов, поставив знаки
или = вместо *:
а) заряд ядра: Mg *
Ca, Na *Mg, Ca * К;б) число электронных слоев: Mg * Ca, Na * Mg,
Ca * К;
в) число электронов на внешнем уровне: Mg * Ca, Na *Mg, Ca * К;
г) радиус атома: Mg * Ca, Na * Mg, Ca * K;
д) восстановительные свойства: Mg * Ca,
Na * Mg, Ca * K.
Слайд 15Допишите уравнения реакций:
а) Са +
H2O→ ……………………….
б)
Mg + НСl→………………………. в) Ва + О2→………………………..
Осуществить превращения по схеме:
Ме → МеО → Ме(ОН)2 → МеSО4