Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Опорный конспект по изопроцессам
Содержание
- 1. Опорный конспект по изопроцессам
- 2. Цели: 1. Образовательные:познакомить учащихся с газовыми законами;обобщить
- 3. Что является объектом изучения МКТ? Идеальный газ.Что
- 4. Макроскопические параметрыПараметры, характеризующие состояние газа без учета его молекулярного строения, называются макроскопическими. ? Назовите эти параметры.
- 5. PдавлениеVобъемTтемпература
- 6. ИзопроцессыПроцессы, протекающие в термодинамической системе при одном
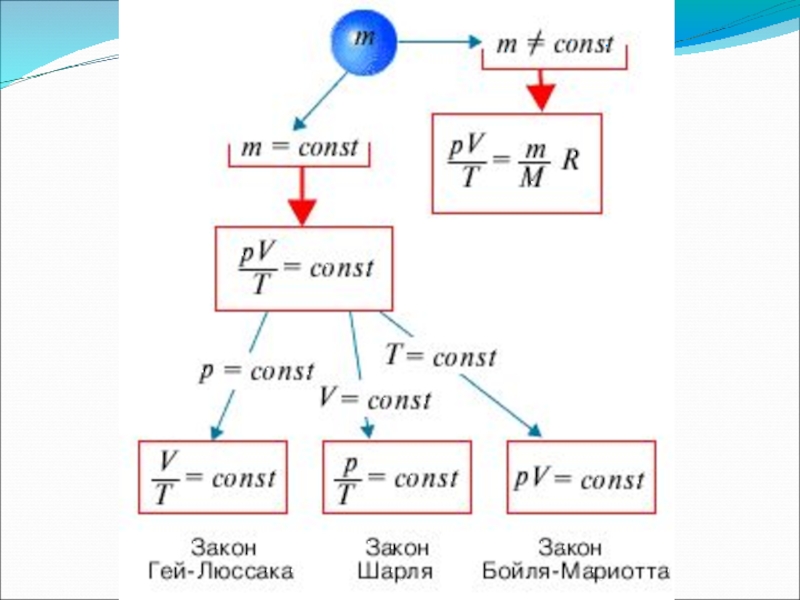
- 7. Уравнение Менделеева-КлапейронаPV=mMRTPVT=constУравнение КлапейронаP1V1T1=P2V2T2Основные термодинамические параметрыp [Па, паскаль]
- 8. Изотермический процессПроцесс, протекающий в термодинамической системе при
- 9. Изотермический (закон Бойля – Мариотта) Роберт Бойль
- 10. Изотермический (закон Бойля – Мариотта)
- 11. Закон Бойля- МариоттаИзотермический процессT1=T2=Tp·v= constp1·V1=p2·V2pV0p0TV0TV1V2p1p2Изотермыp1·V1T1=p2·V2T2T2T1T2>T1Основное уравнение МКТp=
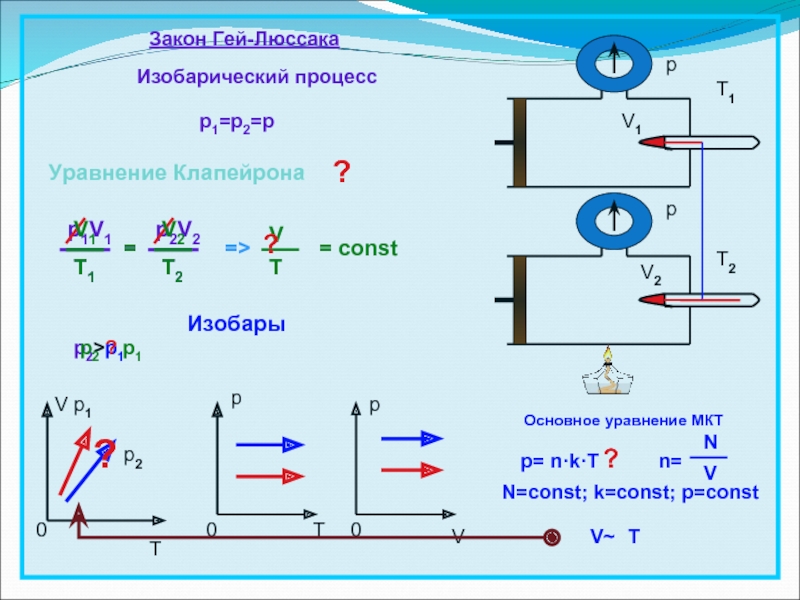
- 12. Изобарный процесс Процесс, протекающий в термодинамической системе
- 13. Изобарный (закон Гей – Люссака)
- 14. Закон Гей-ЛюссакаИзобарический процессp1=p2=p= constVT0p0Tp0VV1V2ppИзобарыp1V1T1=p2V2T2VTV1T1V2T2=T1T2=>Основное уравнение МКТp= n·k·Tn=NVN=const; k=const; p=constV~T?p2>p1p2 ? p1p2p1??Уравнение Клапейрона?
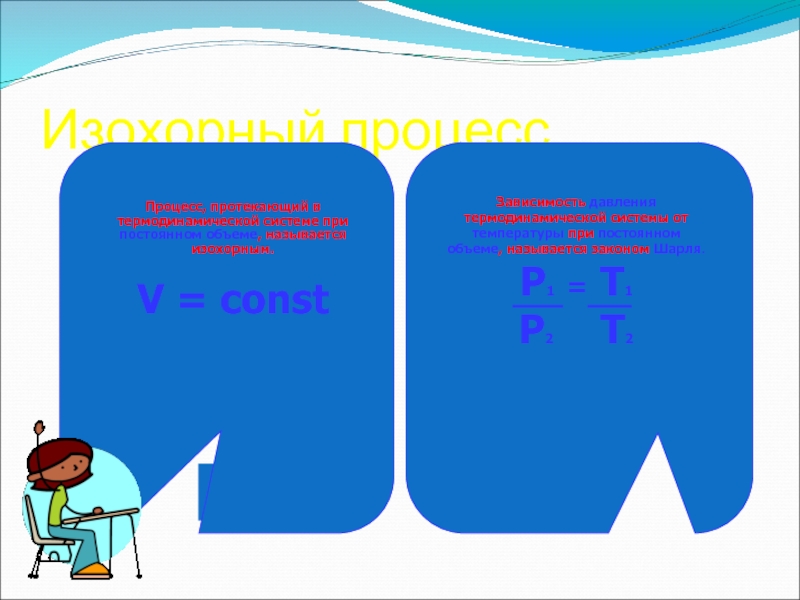
- 15. Изохорный процессПроцесс, протекающий в термодинамической системе при
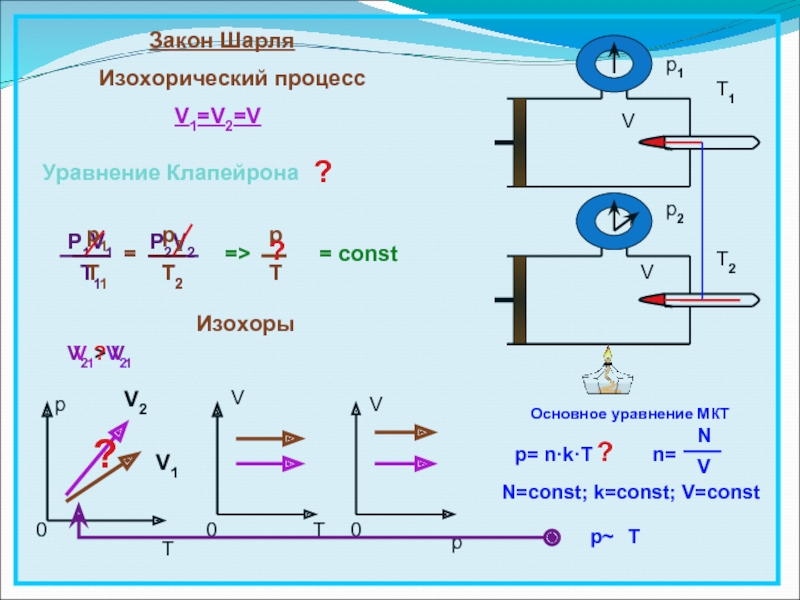
- 16. Изохорный (закон Шарля)
- 17. Закон ШарляИзохорический процессV1=V2=V= constpT0V0TV0pVVp1p2ИзохорыP1V1T1=P2V2T2pTp1T1p2T2=T1T2=>Основное уравнение МКТp= n·k·Tn=NVN=const; k=const; V=constp~T??V1V2V1>V2V2 ? V1?Уравнение Клапейрона?
- 18. Обобщающая таблицаVT--=constPTconst=
- 19. Слайд 19
- 20. Подведем итог:P1 = V2 T =
- 21. Следствия из уравнения состояния закон Авогадро: N=pV/kTпри
- 22. закон ДальтонаДавление смеси газов, не взаимодействующих друг с другом химически, равно сумме парциальных давлений этих газов.
- 23. Решите задачу. При температуре 27oС давление газа
- 24. Домашнее задание: §69; повт. § § 65-68;упражнение 13 №1; Сборник задач А.П. Рымкевич №527; №536
- 25. Прошу Вас оценить урок, насколько он был
- 26. Источники информации 1. Диск «Физика
- 27. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2
Цели:
1. Образовательные:
познакомить учащихся с газовыми законами;
обобщить и систематизировать знания
учащихся о свойствах газов.
2. Развивающие:
создать условия для развития познавательного интереса
учащихся.активизация мыслительной деятельности развитие умений сравнивать,
выявлять закономерности, обобщать, логически мыслить
3. Воспитательные:
продолжить формирование познавательного интереса учащихся;
содействовать формированию у учащихся осознавать
собственную учебную деятельность.
Слайд 3Что является объектом изучения МКТ?
Идеальный газ.
Что в МКТ называется
идеальным газом?
Идеальный газ – это газ, в котором взаимодействием между
молекулами можно пренебречь.Какие три термодинамических параметра используют
для того, чтобы описать состояние идеального газа?
Давление, объем и температура.
Какое уравнение связывает между собой все три термодинамических параметра?
Уравнение состояния идеального газа.
Актуализация знаний
Что вы понимаете под параметрами состояния?
Параметры, описывающие состояние идеального газа
Слайд 4Макроскопические параметры
Параметры, характеризующие состояние газа без учета его молекулярного строения,
называются макроскопическими.
? Назовите эти параметры.
Слайд 6Изопроцессы
Процессы, протекающие в термодинамической системе при одном неизменном макроскопическом параметре
когда два других изменяются, называются изопроцессами.
Изопроцесс – это идеализированная модель реального процесса, которая только приближённо отражает действительность
Слайд 7Уравнение Менделеева-Клапейрона
PV=
m
M
RT
PV
T
=const
Уравнение Клапейрона
P1V1
T1
=
P2V2
T2
Основные термодинамические параметры
p [Па, паскаль] - давление
V [м3,
кубический метр] - объём
Т [К, кельвин] – термодинамическая
температура m=const
Слайд 8Изотермический процесс
Процесс, протекающий в термодинамической системе при постоянной температуре, называется
изотермическим.
T = const
Зависимость объема от давления при постоянной температуре называется
законом Бойля-Мариотта.PV = const
P1 = V2
P2 V1
Слайд 9Изотермический (закон Бойля – Мариотта)
Роберт Бойль (1627—1691) был тринадцатым ребенком
из четырнадцати детей Ричарда Бойля — первого герцога Коркского, свирепого
и удачливого стяжателя, жившего во времена королевы Елизаветы и умножившего свои угодья захватом чужих земель. Он родился в Лисмор Касле, одном из ирландских поместий отца. Там Роберт провел свое детство. Он получил превосходное домашнее образование и в возрасте восьми лет стал студентом Итонского университета. Там он проучился четыре года, после чего уехал в новое поместье отца — Столбридж.Как было принято в то время, в возрасте двенадцати лет Роберта вместе с братом отправили в путешествие по Европе. Он решил продолжить образование в Швейцарии и Италии и пробыл там долгие шесть лет. В Англию Бойль вернулся только в 1644 году, уже после смерти отца, который оставил ему значительное состояние.
Слайд 11Закон Бойля- Мариотта
Изотермический процесс
T1=T2=T
p·v= const
p1·V1=p2·V2
p
V
0
p
0
T
V
0
T
V1
V2
p1
p2
Изотермы
p1·V1
T1
=
p2·V2
T2
T2
T1
T2>T1
Основное уравнение МКТ
p= n·k·T
n=
N
V
N=const; k=const; T=const
р~
1
V
Применение
закона Бойля-Мариотта
Воздушный двигатель
?
=>
?
?
?
T2 ? T1
?
Уравнение Клапейрона
?
Слайд 12Изобарный процесс
Процесс, протекающий в термодинамической системе при постоянном давлении, называется
изобарным.
Р = const
Зависимость объема термодинамической системы от температуры при постоянном
давлении, называется законом Гей-ЛюссакаV1 = T1
V2 T2
Слайд 14Закон Гей-Люссака
Изобарический процесс
p1=p2=p
= const
V
T
0
p
0
T
p
0
V
V1
V2
p
p
Изобары
p1V1
T1
=
p2V2
T2
V
T
V1
T1
V2
T2
=
T1
T2
=>
Основное уравнение МКТ
p= n·k·T
n=
N
V
N=const; k=const; p=const
V~
T
?
p2>p1
p2 ?
p1
p2
p1
?
?
Уравнение Клапейрона
?
Слайд 15Изохорный процесс
Процесс, протекающий в термодинамической системе при постоянном объеме, называется
изохорным.
V = const
Зависимость давления термодинамической системы от температуры при постоянном
объеме, называется законом Шарля.P1 = T1
P2 T2
Слайд 17Закон Шарля
Изохорический процесс
V1=V2=V
= const
p
T
0
V
0
T
V
0
p
V
V
p1
p2
Изохоры
P1V1
T1
=
P2V2
T2
p
T
p1
T1
p2
T2
=
T1
T2
=>
Основное уравнение МКТ
p= n·k·T
n=
N
V
N=const; k=const; V=const
p~
T
?
?
V1
V2
V1>V2
V2 ?
V1
?
Уравнение Клапейрона
?
Слайд 20Подведем итог:
P1 = V2 T = const, закон Бойля-
Мариотта
P2 V1
P1 = T1
V = const, закон ШарляP2 =T2
V1 = T1 Р = const, закон Гей-Люссака
V2 T2
Слайд 21Следствия из уравнения состояния
закон Авогадро:
N=pV/kT
при равных давлениях и температуре
в одинаковых объёмах любых газов содержится одинаковое число молекул
Слайд 22закон Дальтона
Давление смеси газов, не взаимодействующих друг с другом химически,
равно сумме парциальных давлений этих газов.
Слайд 23Решите задачу. При температуре 27oС давление газа в закрытом сосуде
было 75 кПа. Каким будет давление этого газа при температуре
-13oС?Слайд 24
Домашнее задание:
§69; повт. § § 65-68;
упражнение 13 №1;
Сборник
задач А.П. Рымкевич №527; №536
Слайд 25
Прошу Вас оценить урок, насколько он был успешен.
Мне все понравилось
Мне
ничего не понравилось
Мне ничего не понятно
Мне было интересно
Мне было скучно
Мне
было легкоМне было трудно
Я узнал много нового
Я не узнал ничего нового
Слайд 26Источники информации
1. Диск «Физика 7-11 классы. Библиотека
наглядных пособий» из серии 1С: Образование, 2003-2006
2.
Программы для общеобразовательных учреждений. Г.Я. Мякишев. Физика. Астрономия. 7-11 кл.-М.: Дрофа,2002
3. Г. Я. Мякишев, Б.Б. Буховцев, Н.Н. Сотский. Физика.
Учебник для 10 кл. Москва: Просвещение,2007.-366 с.
4. Поурочные планы по учебнику Г.Я. Мякишева и др.
Сост. И.И. Мокрова.-Волгоград: Учитель-АСТ, 2005.-112 с.






![Опорный конспект по изопроцессам Уравнение Менделеева-КлапейронаPV=mMRTPVT=constУравнение КлапейронаP1V1T1=P2V2T2Основные термодинамические параметрыp [Па, паскаль] - давлениеV [м3, кубический Уравнение Менделеева-КлапейронаPV=mMRTPVT=constУравнение КлапейронаP1V1T1=P2V2T2Основные термодинамические параметрыp [Па, паскаль] - давлениеV [м3, кубический метр] - объёмТ [К, кельвин] –](/img/thumbs/50f1e6d7d8a8ba0c56493a7dc7b96f8d-800x.jpg)