Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация по теме подгруппа углерода
Содержание
- 1. Презентация по теме подгруппа углерода
- 2. Цели урока:Дать общую характеристику подгруппы углерода. Рассмотреть
- 3. Слайд 3
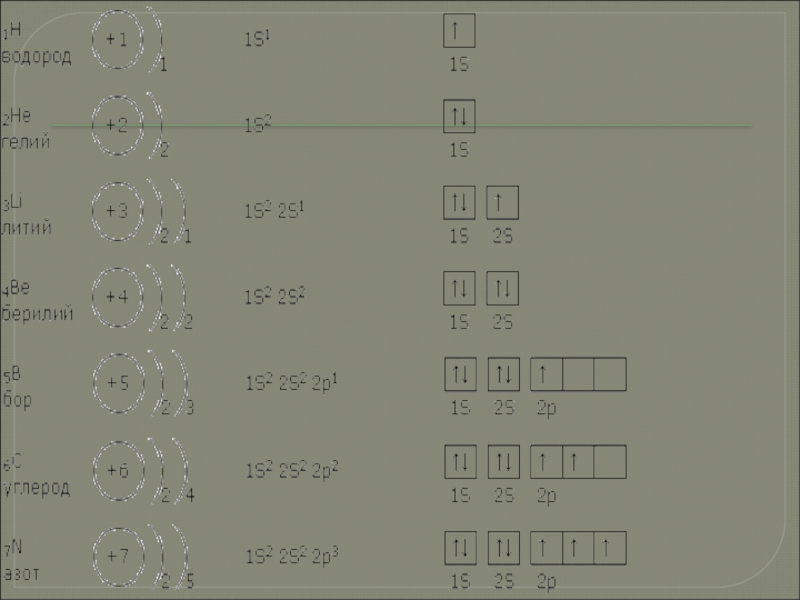
- 4. На внешней электронной оболочке атомов имеется 4
- 5. C Углерод Латинское название саrboneum от лат. «carbo» - уголь.
- 6. Строение атома
- 7. Положение углерода в периодической таблице. Заряд ядра
- 8. Положение в таблице МенделееваЗаряд ядра +6C, порядковый
- 9. Слайд 9
- 10. Слайд 10
- 11. История открытия углерода Углерод является одним
- 12. Первое получение свободного углеродаВ 1791 году английский
- 13. углеродУглерод занимает 17-е место по распространенности в
- 14. C – алмаз, графит.CaCO3 – мел, известняк, мрамор.MgCO3- магнезитFeCO3 - сидерит нахождение углерода в природе
- 15. Распространение углерода в природе Углерод широко распространен
- 16. В ископаемых углях его содержится: от 92
- 17. В воздухе углерод содержится в виде углекислого
- 18. Углерод входит в состав растений и животных, содержится в нефти и природном газе.
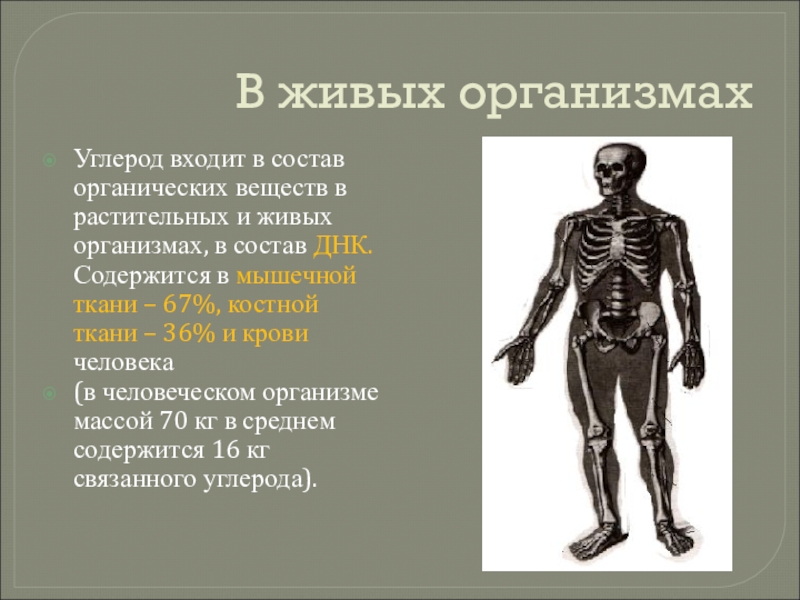
- 19. В живых организмахУглерод входит в состав органических
- 20. Содержание в
- 21. Аллотропные модификации углерода
- 22. Углерод образует аллотропные модификации : алмаз графит карбин фуллерен
- 23. Причина этого явления состоит в разном строении
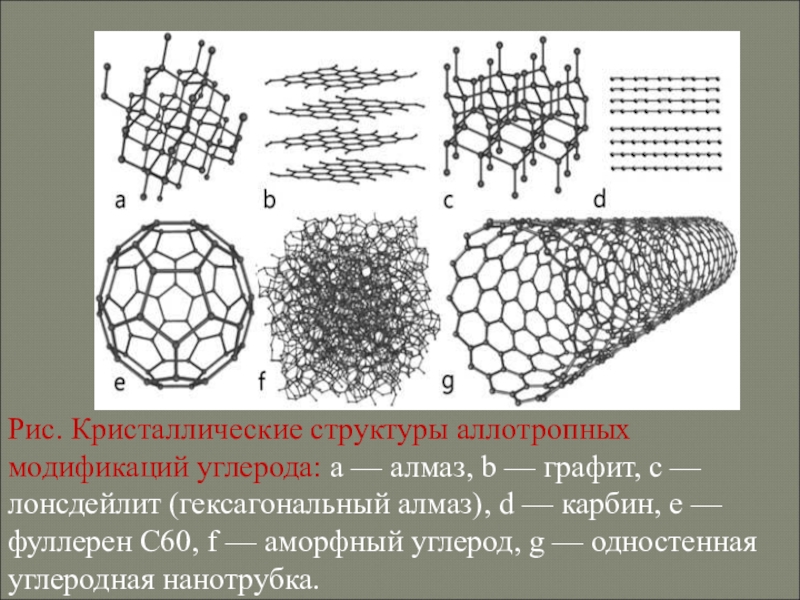
- 24. Рис. Кристаллические структуры аллотропных модификаций углерода: a —
- 25. Физические свойства
- 26. АЛМАЗ
- 27. При слове «алмаз» сразу же вспоминаются окутанные
- 28. Алмаз
- 29. Очень твердый, прозрачный, бесцветный минерал, но хрупкий, ток не проводит.
- 30. АлмазПлотность алмаза – 3,5 г/см3, tплав=3730С, tкип=4830оС.
- 31. АлмазАлмазы очень редки и ценны, их вес
- 32. ГРАФИТ
- 33. ГрафитГрафит – устойчивая при нормальных условиях аллотропная
- 34. В древности графит считали одним из минералов
- 35. ГрафитАтомы углерода в графите расположены отдельными слоями,
- 36. Графит
- 37. ГрафитГрафит характеризуется меньшей плотностью и твердостью, а
- 38. ФУЛЛЕРЕН
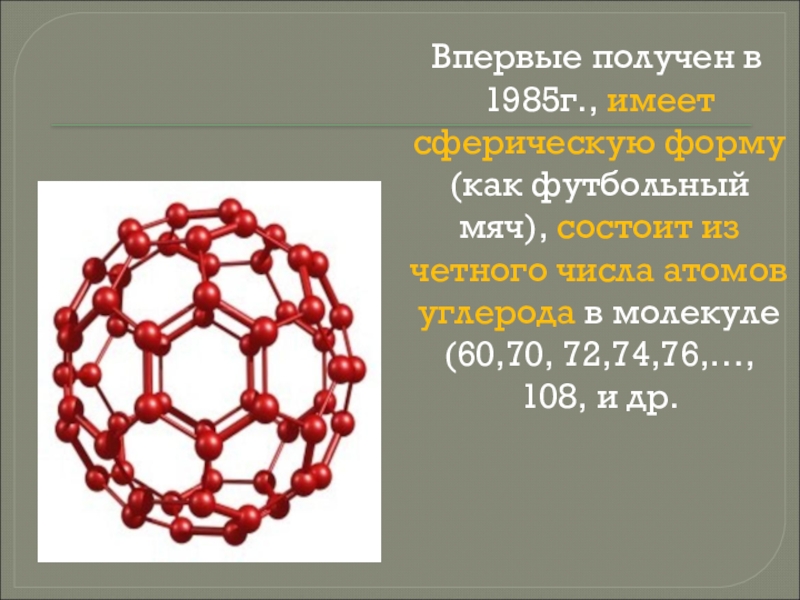
- 39. Впервые получен в 1985г., имеет сферическую форму
- 40. 1992 году фуллерены обнаружены в природе –
- 41. Модель фуллерена С60
- 42. ФуллереныПроисхождение термина "фуллерен" связано с именем американского
- 43. КарбинКарбин был получен в начале 60-х годов.
- 44. КарбинОн имеет вид черного мелкокристаллического порошка, однако
- 45. Адсорбция – это поглощение газов или растворенных веществ поверхностью твердого вещества.
- 46. ХИМИЧЕСКИЕ СВОЙСТВА
- 47. В нормальных условиях углерод химически малоактивен, однако
- 48. Реакции с простыми веществами16.12.13
- 49. 1. При нагревании углерод соединяются с кислородом,
- 50. 3. С водородом углерод соединяется только при
- 51. 4. Углерод взаимодействует при нагревании с серой
- 52. 5. С металлами при нагревании образует карбиды. 2C+Ca=CaC2 4Al+3C=Al4C3
- 53. Реакции со сложными веществами
- 54. Углерод – сильный восстановитель. 1. При нагревании
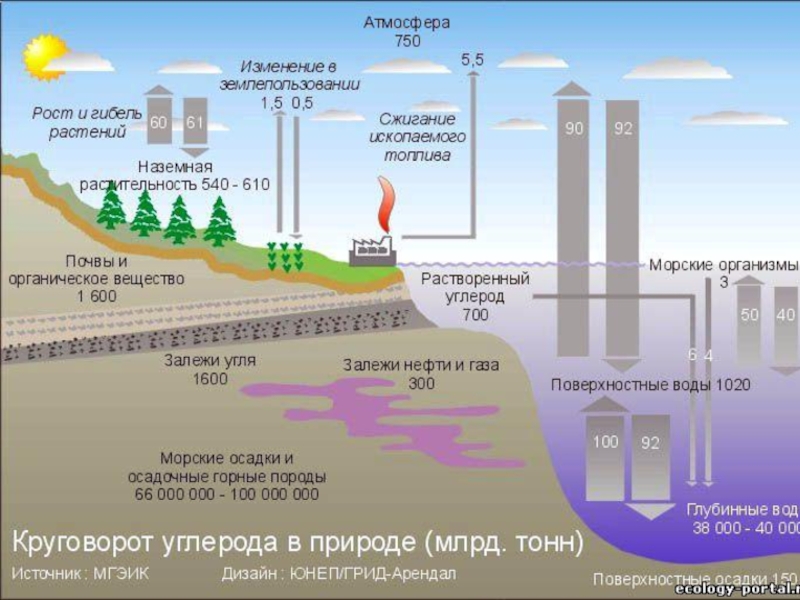
- 55. КРУГОВОРОТ УГЛЕРОДА В ПРИРОДЕ
- 56. Слайд 56
- 57. Слайд 57
- 58. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1МКОУ лицей №4
г. Россошь
Воронежская область
Выполнила:
Учитель химии МКОУ лицей №4
Суглобова И.В.
Слайд 2Цели урока:
Дать общую характеристику подгруппы углерода.
Рассмотреть строение атома углерода,
его аллотропные модификации, физические и химические свойства углерода, нахождение его
в природе, применение.Слайд 3
Подгруппа углерода, в которую входят
углерод, кремний, германий, олово и
свинец,
является главной подгруппой IV группы Периодической системы.
Слайд 4На внешней электронной оболочке атомов имеется 4 электрона и их
электронную конфигурацию в общем виде можно записать так: ns2np2 При
переходе сверху вниз по группе неметаллические свойства ослабляются, а металлические возрастают. Проявляют степени окисления -4, 0, +2 и +4. Проявляют высшую валентность IV, но возможна и II
Слайд 7Положение углерода в периодической таблице. Заряд ядра атома углерода. Электронная схема. Электронная формула. Электронно
– графическая формула.
Формула возбужденного состояния атома углерода.
Слайд 8Положение в таблице Менделеева
Заряд ядра +6C, порядковый номер 6. Располагается
в главной подгруппе IV группы, 2 малом периоде, 2 четным
ряду.Углерод - типичный неметалл.
Слайд 11История открытия углерода
Углерод является одним из первых химических
элементов, который известен человеку. С незапамятных времён человек использовал уголь
и сажу. Когда наши предки овладели огнём, а это было около 100 тысяч лет назад, они имели дело с углём и сажей. По всей видимости, люди знакомы очень давно с разновидностями углерода, аллотропными модификациями – алмазом, графитом и каменным углем.Слайд 12Первое получение свободного углерода
В 1791 году английский химик Теннант первым
получил свободный углерод; он пропускал пары фосфора над прокалённым мелом,
в результате чего образовывались фосфат кальция и углерод.Слайд 13углерод
Углерод занимает 17-е место по распространенности в земной коре –
0,048%. Но несмотря на это, он играет огромную роль в
живой и неживой природе.Слайд 14
C – алмаз, графит.
CaCO3 – мел, известняк, мрамор.
MgCO3- магнезит
FeCO3 -
сидерит
нахождение углерода
в природе
Слайд 15
Распространение углерода в природе
Углерод широко распространен также в космосе.
на
Солнце он занимает 4-е место после водорода, гелия и кислорода.
Слайд 17В воздухе углерод содержится в виде углекислого газа (0.03 %
по объему). Содержится углерод и в соединениях, растворенных в морской
воде.
Слайд 19В живых организмах
Углерод входит в состав органических веществ в растительных
и живых организмах, в состав ДНК. Содержится в мышечной ткани
– 67%, костной ткани – 36% и крови человека(в человеческом организме массой 70 кг в среднем содержится 16 кг связанного углерода).
Слайд 20
Содержание в живых организмах
В наземных растениях, животных и бактериях 54%
В водных растениях и
животных 45,4-46,5%Содержится в виде белков, жиров и углеводов.
Слайд 23Причина этого явления состоит в разном строении кристаллических решеток: алмаз
имеет объемную тетраэдрическую атомную решетку; графит – плоскостную атомную кристаллическую
решетку; карбин – линейную; фуллерен – сферическую.
Слайд 24Рис. Кристаллические структуры аллотропных модификаций углерода: a — алмаз, b — графит,
c — лонсдейлит (гексагональный алмаз), d — карбин, e — фуллерен C60, f — аморфный
углерод, g — одностенная углеродная нанотрубка.Слайд 27При слове «алмаз» сразу же вспоминаются окутанные завесой тайны истории,
повествующие о поисках сокровищ.
Когда-то люди, охотившиеся за алмазами, и
не подозревали, что предметом их страсти является кристаллический углерод – тот самый углерод, который образует сажу, копоть и уголь.Впервые это доказал Лавуазье. Он поставил опыт по сжиганию алмаза, используя собранную специально для этой цели зажигательную машину. Оказалось, алмаз сгорает на воздухе при температуре 7000С, не оставляя твердого остатка, как и обычный уголь.
Слайд 30Алмаз
Плотность алмаза – 3,5 г/см3, tплав=3730С, tкип=4830оС.
Алмаз можно получить
из графита при p > 50 тыс. атм. и tо
= 1200оCСлайд 31Алмаз
Алмазы очень редки и ценны, их вес измеряется в каратах
(1 карат=200мг). Ограненный алмаз называют бриллиантом.
Знаменитый бриллиант «Кохинор»
Слайд 33Графит
Графит – устойчивая при нормальных условиях аллотропная модификация углерода, имеет
серо-черный цвет и металлический блеск, кажется жирным на ощупь, очень
мягок и оставляет черные следы на бумаге.Структура графита
Слайд 34В древности графит считали одним из минералов свинца, возможно из-за
того, что, подобно свинцу, он оставляет на бумаге след.
В
XVIII в. К.В.Шееле доказал, что графит представляет собой «особый минеральный уголь». Луи Бернар Гитон де Морво при осторожном нагревании алмаза без доступа воздуха получил порошок графита.
Слайд 35Графит
Атомы углерода в графите расположены отдельными слоями, образованными из плоских
шестиугольников. Каждый атом углерода на плоскости окружен тремя соседними, расположенными
вокруг него в виде правильного треугольника.Слайд 37Графит
Графит характеризуется меньшей плотностью и твердостью, а также графит может
расщепляться на тонкие чешуйки. Чешуйки легко прилипают к бумаге –
вот почему из графита делают грифели карандашей. В пределах шестиугольников возникает склонность к металлизации, что объясняет хорошую тепло- и электропроводность графита, а также его металлический блеск.Графитовый электрод
Слайд 39Впервые получен в 1985г., имеет сферическую форму (как футбольный мяч),
состоит из четного числа атомов углерода в молекуле (60,70, 72,74,76,…,
108, и др.
Слайд 401992 году фуллерены обнаружены в природе – в минерале шунгите
(аморфном углероде), названном в честь поселка Шуньга в Карелии. Неудивительно,
что долгое время примесь фуллерена в шунгите не замечали: его там лишь около 0,001%.
Слайд 42Фуллерены
Происхождение термина "фуллерен" связано с именем американского архитектора Ричарда Букминстера
Фуллера, конструировавшего полусферические архитектурные конструкции, состоящие из шестиугольников и пятиугольников.
Купол
ФуллераСлайд 43Карбин
Карбин был получен в начале 60-х годов.
Карбин имеет линейную
кристаллическую структуру, в которой атомы углерода соединены чередующимися одинарными и
тройными связями.Строение карбина
Слайд 44Карбин
Он имеет вид черного мелкокристаллического порошка, однако может существовать в
виде белого вещества с промежуточной плотностью.
Карбин обладает полупроводниковыми свойствами,
под действием света его проводимость резко увеличивается. Слайд 47В нормальных условиях углерод химически малоактивен, однако при высокой температуре
он реагирует со многими веществами.
Самой активной формой является аморфный
углерод, менее активен графит, самый инертный – алмаз.Слайд 491. При нагревании углерод соединяются с кислородом, образуя оксид углерода
(IV), или углекислый газ: С + O2 = CO2 2. При недостатке
кислорода образуется оксид углерода (II), или угарный газ: 2С + О2 = 2СО
Слайд 503. С водородом углерод соединяется только при высоких температурах и
в присутствии катализаторов. В зависимости от температуры образуются различные углеводороды,
например, метан:С + 2H2 = CH4
Слайд 514. Углерод взаимодействует при нагревании с серой и фтором, в
электрической дуге с азотом: С + 2S = CS2 С + 2F2
= CF4 2С + N2 = (CN)2
Слайд 54Углерод – сильный восстановитель.
1. При нагревании с водяным паром
он вытесняет из воды водород:
Н2O + С = СО +
Н22. При нагревании углерода с оксидом углерода (IV) образуется угарный газ:
С + СО2 = 2СО
3. Углерод восстанавливает многие металлы из их оксидов:
2Fe2O3 + 3С = 4Fe + 3CO2