Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Многофункциональные биомолекулы
Содержание
- 1. Многофункциональные биомолекулы
- 2. Мультифункціональні біомолекулиМолекули, що змінюють хімічні властивості під
- 3. Фотохімічна активація ферментативних реакцій I. Willner, B.
- 4. P. K. Agarwal, C. Schultz, A. Kalivretenos,
- 5. Активність фермента у фотоактивованому стані (при освітленні)
- 6. Фотопереключення іонотропного рецептору глутаматуP. Gorostiza, M. Volgraf,
- 7. Шляхи зєднання MAG-1 до iGluR6-L439C:(a) перехід в
- 8. Фотоактивний протеїнJ. Bredenbeck, J. Helbing, A. Sieg,
- 9. Фотоактивний протеїнJ. Bredenbeck, J. Helbing, A. Sieg,
- 10. Y. Zhang, F.Lu, K.G. Yager, D. van
- 11. Зборка систем різних наночастинок за допомогою ДНКФормування
- 12. Зборка систем різних наночастинок за допомогою ДНКНаночастинки,
- 13. Малокутове розсіювання рентгенівських променів (SAXS).Наявність максимумів є
- 14. Зборка систем різних наночастинок за допомогою ДНКАгрегати
- 15. Залежність швидкості процесу перетворення Фази-F на Фазу-D
- 16. Візуалізація виділення Са2+ за допомогою зеленого флуоресцентного
- 17. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2
Мультифункціональні біомолекули
Молекули, що змінюють хімічні властивості під зовнішнім фізичним впливом
Молекули,
що використовуються для надання нових властивостей іншим системам
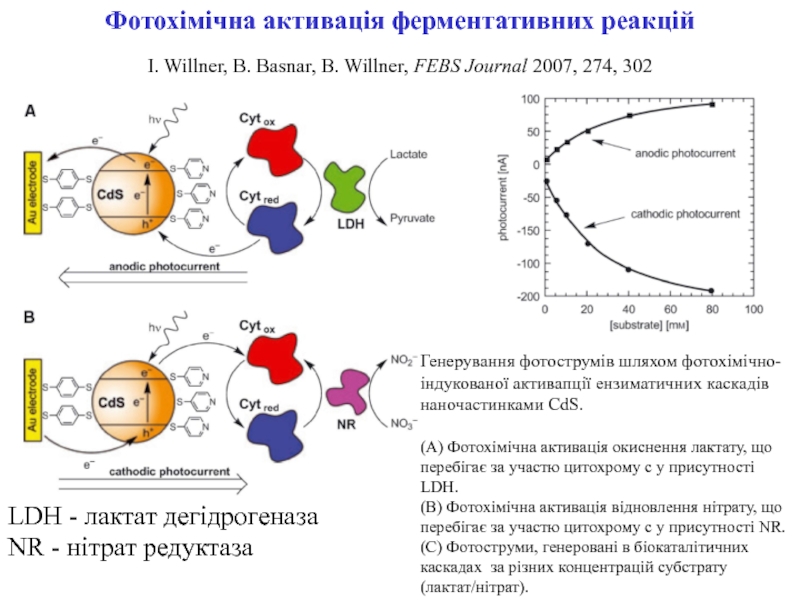
Слайд 3Фотохімічна активація ферментативних реакцій
I. Willner, B. Basnar, B. Willner,
FEBS Journal 2007, 274, 302
Генерування фотострумів шляхом фотохімічно-індукованої активапції ензиматичних
каскадів наночастинками CdS. (A) Фотохімічна активація окиснення лактату, що перебігає за участю цитохрому с у присутності LDH.
(B) Фотохімічна активація відновлення нітрату, що перебігає за участю цитохрому с у присутності NR.
(C) Фотоструми, генеровані в біокаталітичних каскадах за різних концентрацій субстрату (лактат/нітрат).
LDH - лактат дегідрогеназа
NR - нітрат редуктаза
Слайд 4P. K. Agarwal, C. Schultz, A. Kalivretenos, B. Ghosh, S.
E. Broedel, Jr.J. Phys. Chem. Lett. 2012, 3, 1142
Схема з’єднання
азобензенового містку і ензимуЛіпаза В Candida antarctica
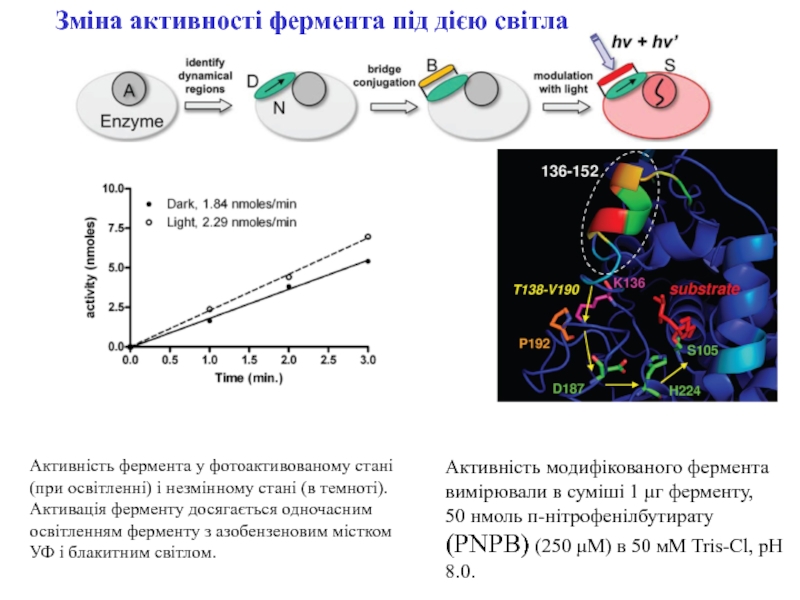
Зміна активності фермента під дією світла
Слайд 5Активність фермента у фотоактивованому стані (при освітленні) і незмінному стані
(в темноті).
Активація ферменту досягається одночасним освітленням ферменту з азобензеновим містком
УФ і блакитним світлом. Активність модифікованого фермента вимірювали в суміші 1 μг ферменту,
50 нмоль п-нітрофенілбутирату (PNPB) (250 μM) в 50 мМ Tris-Cl, pH 8.0.
Зміна активності фермента під дією світла
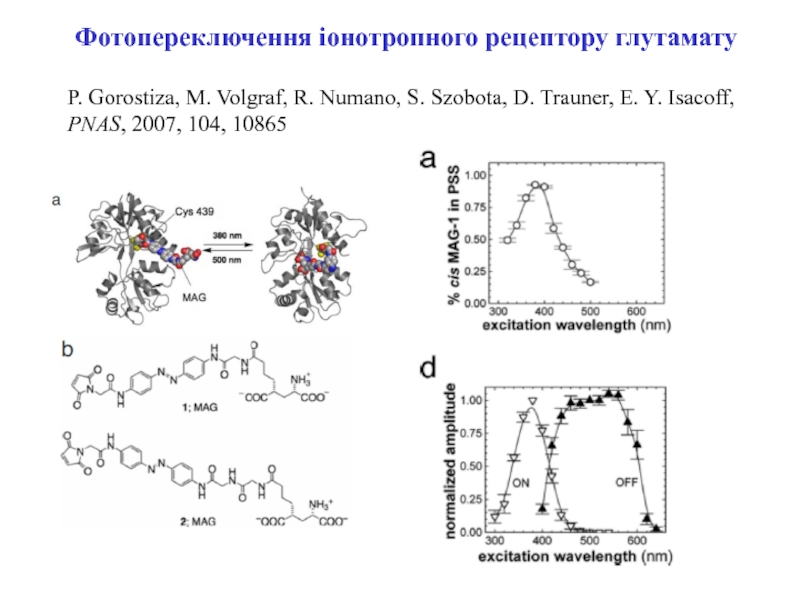
Слайд 6Фотопереключення іонотропного рецептору глутамату
P. Gorostiza, M. Volgraf, R. Numano, S.
Szobota, D. Trauner, E. Y. Isacoff, PNAS, 2007, 104, 10865
Слайд 7Шляхи зєднання MAG-1 до iGluR6-L439C:
(a) перехід в транс-конформацію при освітленні
світлом з довжиною хвилі 500 нм
б) заповнення сайту звязування MAG-1
з використанням високої концентрації глутаматуLBD = сайт звязування ліганду (ligand binding site)
Фотопереключення іонотропного рецептору глутамату
P. Gorostiza, M. Volgraf, R. Numano, S. Szobota, D. Trauner, E. Y. Isacoff, PNAS, 2007, 104, 10865
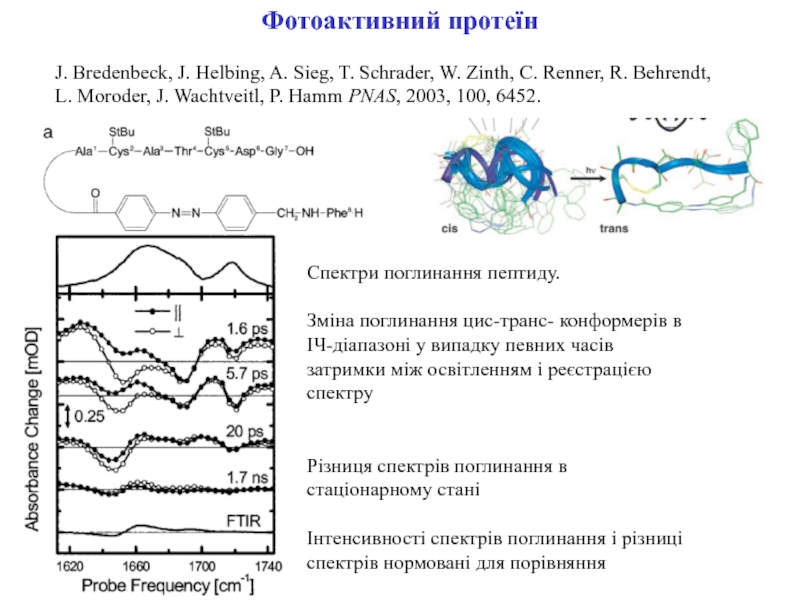
Слайд 8Фотоактивний протеїн
J. Bredenbeck, J. Helbing, A. Sieg, T. Schrader, W.
Zinth, C. Renner, R. Behrendt,
L. Moroder, J. Wachtveitl, P. Hamm
PNAS, 2003, 100, 6452.Спектри поглинання пептиду.
Зміна поглинання цис-транс- конформерів в ІЧ-діапазоні у випадку певних часів затримки між освітленням і реєстрацією спектру
Різниця спектрів поглинання в стаціонарному стані
Інтенсивності спектрів поглинання і різниці спектрів нормовані для порівняння
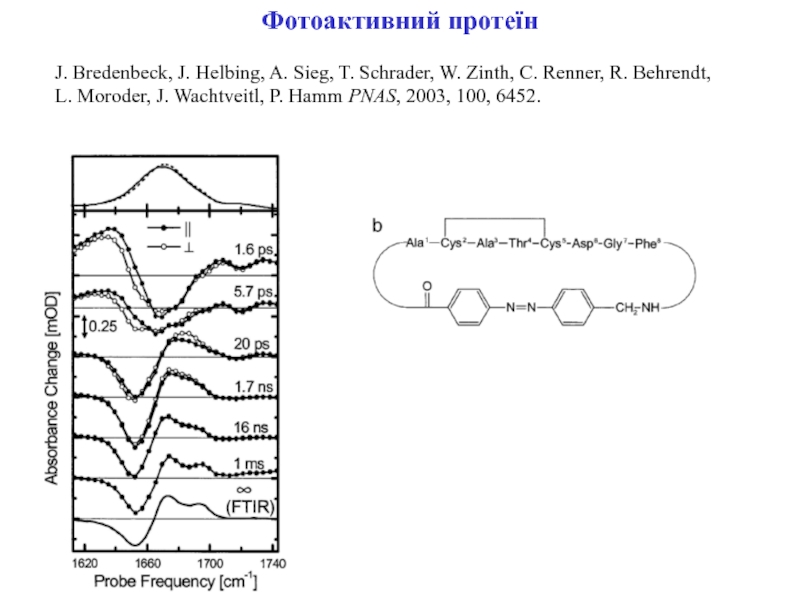
Слайд 9Фотоактивний протеїн
J. Bredenbeck, J. Helbing, A. Sieg, T. Schrader, W.
Zinth, C. Renner, R. Behrendt,
L. Moroder, J. Wachtveitl, P. Hamm
PNAS, 2003, 100, 6452.Слайд 10
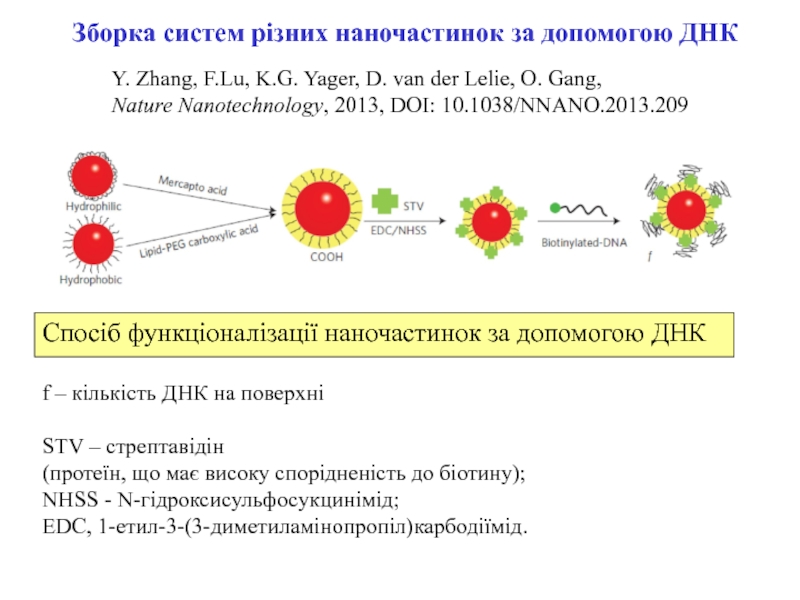
Y. Zhang, F.Lu, K.G. Yager, D. van der Lelie, O.
Gang,
Nature Nanotechnology, 2013, DOI: 10.1038/NNANO.2013.209
Зборка систем різних наночастинок за
допомогою ДНКf – кількість ДНК на поверхні
STV – стрептавідін
(протеїн, що має високу спорідненість до біотину);
NHSS - N-гідроксисульфосукцинімід;
EDC, 1-етил-3-(3-диметиламінопропіл)карбодіїмід.
Спосіб функціоналізації наночастинок за допомогою ДНК
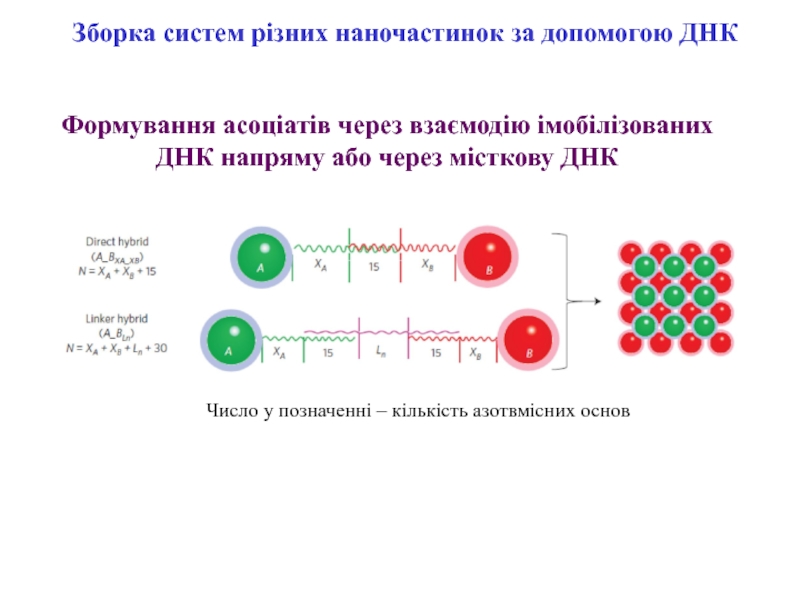
Слайд 11Зборка систем різних наночастинок за допомогою ДНК
Формування асоціатів через взаємодію
імобілізованих ДНК напряму або через місткову ДНК
Число у позначенні –
кількість азотвмісних основСлайд 12
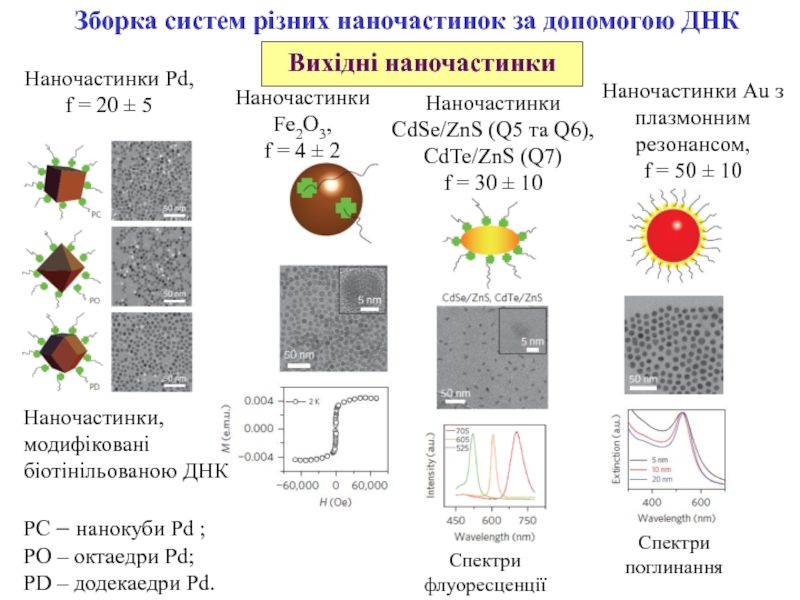
Зборка систем різних наночастинок за допомогою ДНК
Наночастинки, модифіковані
біотінільованою ДНК
PC
– нанокуби Pd ;
PO – октаедри Pd;
PD – додекаедри Pd.
Наночастинки
Pd,f = 20 ± 5
Наночастинки
Fe2O3,
f = 4 ± 2
Наночастинки
CdSe/ZnS (Q5 та Q6),
CdTe/ZnS (Q7)
f = 30 ± 10
Наночастинки Au з плазмонним резонансом,
f = 50 ± 10
Спектри флуоресценції
Спектри поглинання
Вихідні наночастинки
Слайд 13Малокутове розсіювання рентгенівських променів (SAXS).
Наявність максимумів є ознакою утворення впорядкованої
структури. Шляхом симуляції спектру можна встановити тип кристалічної супер-гратки
Зборка систем
різних наночастинок за допомогою ДНКМетод дослідження
Наночастинки Pd/Au
Залежність відстані між частинками
від їх форми
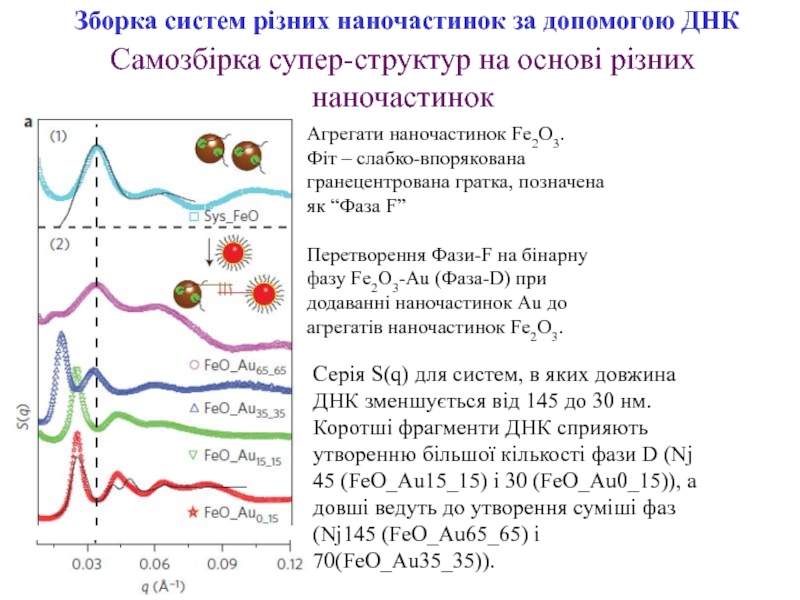
Слайд 14Зборка систем різних наночастинок за допомогою ДНК
Агрегати наночастинок Fe2O3.
Фіт –
слабко-впорякована гранецентрована гратка, позначена як “Фаза F”
Перетворення Фази-F на бінарну
фазу Fe2O3-Au (Фаза-D) при додаванні наночастинок Au до агрегатів наночастинок Fe2O3.Самозбірка супер-структур на основі різних наночастинок
Серія S(q) для систем, в яких довжина ДНК зменшується від 145 до 30 нм.
Коротші фрагменти ДНК сприяють утворенню більшої кількості фази D (Nј
45 (FeO_Au15_15) і 30 (FeO_Au0_15)), а довші ведуть до утворення суміші фаз (Nј145 (FeO_Au65_65) і 70(FeO_Au35_35)).
Слайд 15Залежність швидкості процесу перетворення Фази-F на Фазу-D від довжини ДНК.
Зборка систем різних наночастинок за допомогою ДНК
Слайд 16Візуалізація виділення Са2+ за допомогою зеленого флуоресцентного протеїну
Q. Chen, J.
Cichon, W. Wang, L. Qiu, S.-J. R. Lee, N. R.
Campbell, N. DeStefino,M. J. Goard, Z. Fu, R. Yasuda, L. L. Looger, B. R. Arenkiel, W.-B. Gan, G. Feng
Neuron 2012, 76, 297
Комунікація нейронів супроводжується виділенням або поглинанням кальцію.
За допомогою модифікованого зеленого флуоресцентного протеїну, що чутливий до кальцію, можна візуалізувати активність неронів в режимі реального часу.