Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Азотная кислота
Содержание
- 1. Азотная кислота
- 2. Путешествие в мир соединений азота
- 3. Соединения азотаСтанция «Безопасная»Станция «Повторительная»
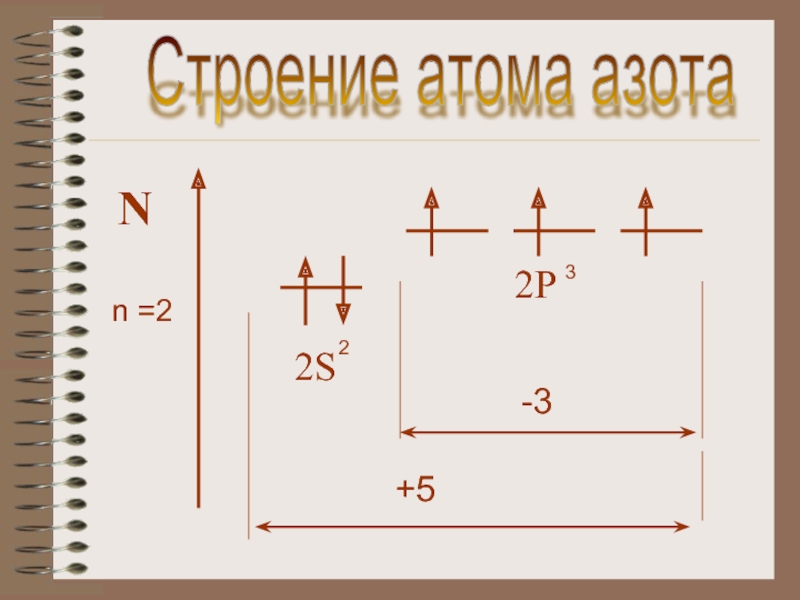
- 4. N2S2P-3+5n =223Строение атома азота
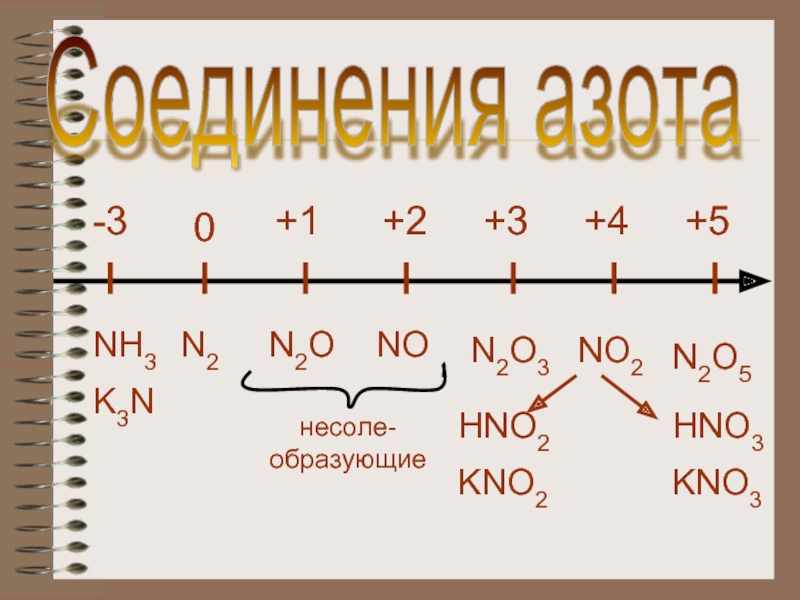
- 5. +10+2+3+4+5-3N2NH3N2ONON2O3HNO2NO2N2O5HNO3K3Nнесоле-образующиеKNO2KNO3Соединения азота
- 6. 1. NO2; N2O; NaNO3; N2O3 ;
- 7. Состав и строениеФизические свойстваХимические свойства а)общие
- 8. Составлять уравнения реакций, характеризующих химические свойства азотной
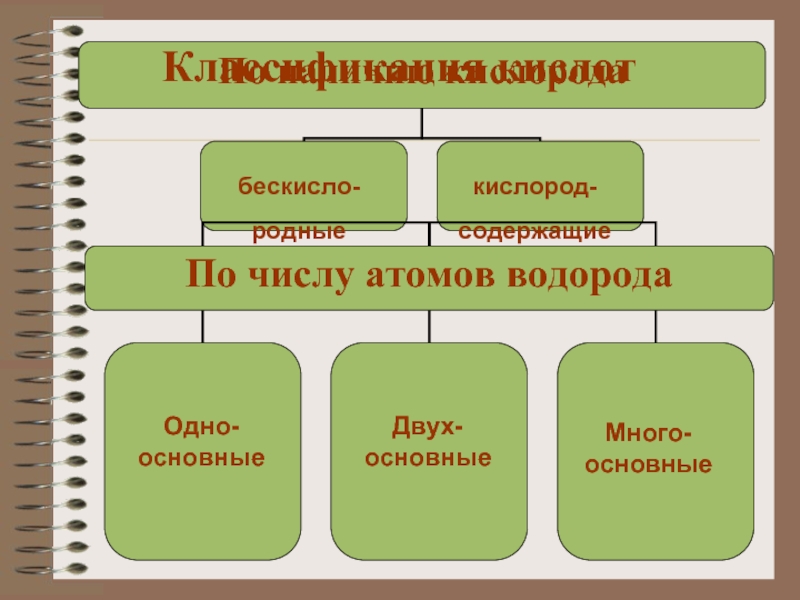
- 9. Классификация кислотбескисло-родные кислород-содержащиеОдно-основныеДвух-основныеМного-основные
- 10. Химическая формула-HNO3Вид химической связи-ковалентная полярнаяС. O. азота - +5Состав и строение молекулы
- 11. Ж, Ц , ρ = 1,5 г/мл;
- 12. (общие с другими кислотами)Диссоциация:С основаниями:С основными
- 13. HNO3 – СИЛЬНЫЙ ОКИСЛИТЕЛЬ+5Cu + HNO3(к)
- 14. Взаимодействие азотной кислоты с металламиNO2 NONH4NO3 AgCuZnКонцентрированная азотная кислотаРазбавленная азотная кислотаОчень разбавленная азотная кислота+4+2-3
- 15. При взаимодействии азотной кислоты с металлами не
- 16. Желаю успеха !А., §7,8; с.27, упр.1-4Домашнее задание
- 17. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Путешествие в мир
соединений азота
Маршрут (план урока)
Станция «Повторительная»
Станция «Разминочная»
Станция
«Информационная»
Слайд 6
1. NO2; N2O; NaNO3; N2O3 ; N2O5
2. HNO3;
Ca(NO3)2; N2O5; NaNO2
3. NO2; N2O;
N2O3 ; N2O5Химическая разминка
Станция «Разминочная»
Слайд 7Состав и строение
Физические свойства
Химические свойства
а)общие с другими
кислотами
б)особые свойства
азотной кислотыЧто мы узнаем?
(План изучения темы)
Азотная кислота
Станция «Информационная»
Слайд 8Составлять уравнения реакций, характеризующих
химические свойства
азотной кислоты;
Определять продукты
ОВР с участием
азотной кислоты.
Чему мы научимся?
Азотная кислота
Слайд 9Классификация кислот
бескисло-
родные
кислород-
содержащие
Одно-
основные
Двух-
основные
Много-
основные
Слайд 10Химическая формула-
HNO3
Вид химической связи-
ковалентная полярная
С. O. азота -
+5
Состав и
строение молекулы
Слайд 11Ж, Ц , ρ = 1,5 г/мл;
t°кип= 86°С,
желтеет
при хранении взрывоопасна.
Физические свойства
2004г. Свердловская область.
Из-за утечки азотной кислоты
(около 10 кубометров) вспыхнул крупный пожар. Для его ликвидации спасателям понадобилось 5 часов.Слайд 12(общие с другими кислотами)
Диссоциация:
С основаниями:
С основными
оксидами:
С солями (↑):
С Ме до Н:
H+ + OH- = Н2O
2H+
+ CuO = Cu2+ + 2H2OHNO3 ↔ H+ + NO3-
2H+ + СаСО3 = Са2+ + СО2 + Н2О
Химические свойства
Станция «Экспериментальная»
Слайд 13HNO3 – СИЛЬНЫЙ ОКИСЛИТЕЛЬ
+5
Cu + HNO3(к) →
Cu(NO3)2
+ NO2
+
H2O
0
+2
+5
+4
4
2
1. + Ме → водород не выделяется !
2
2. +
неМе → кислота:Р + 5HNO3 →
Н3РО4 +
5NO2↑
+ Н2О
3. Разложение:
4HNO3→
4NO2↑ + О2↑ + 2Н2О
Особые свойства
Слайд 14Взаимодействие азотной кислоты с металлами
NO2
NO
NH4NO3
Ag
Cu
Zn
Концентрированная азотная кислота
Разбавленная азотная
кислота
Очень разбавленная азотная кислота
+4
+2
-3
Слайд 15При взаимодействии азотной кислоты с металлами не образуется:
3) водород;
Азотная кислота не взаимодействует:
1) с оксидом углерода (IV);
2) с оксидом меди (II);
3) с карбонатом калия;
4) с гидроксидом меди(III).
1) соль;
4) оксид азота.
2) вода;
Молодцы!
Проверь себя