Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация по теме:"Соли аммония"
Содержание
- 1. Презентация по теме:"Соли аммония"
- 2. Цели:углубить и расширить знания учащихся о солях,
- 3. «Химии никоим образом научиться невозможно, не видав
- 4. I. Организационный этап.II. Проверка домашнего задания.III. Изучение нового материала 4План урока
- 5. Соли аммония– соли содержащие сложный ион NH4+,
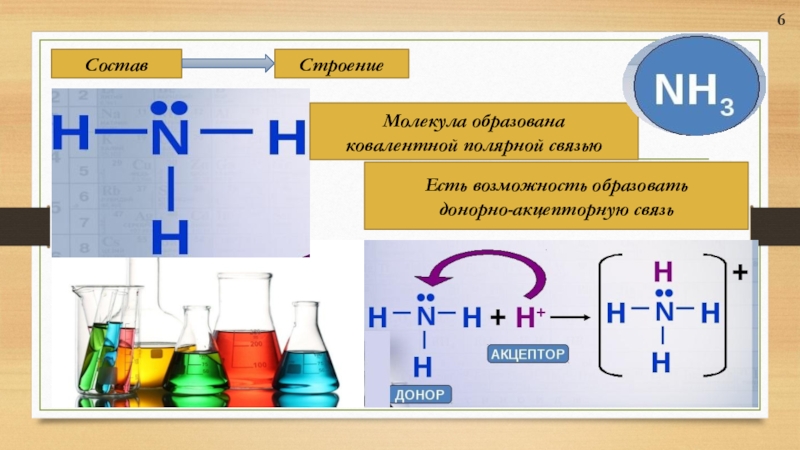
- 6. Состав Строение Есть возможность образовать донорно-акцепторную связь Молекула образована ковалентной полярной связью 6
- 7. СОЛИ АММОНИЯ7(NH4)2SO4 сульфат аммония(NH4)2HPO4 гидрофосфат аммонияNH4NO3 нитрат
- 8. Задание № 1. Обсуждение физических свойств солей
- 9. Химические свойства солей аммонияВспомните правила Т/Б!9Вспомните о химических свойствах солей металлов!
- 10. Задание № 2: практическим путем, соблюдая
- 11. Задание № 3. Записать уравнение электролитической диссоциации
- 12. Качественная реакция на ион аммонияИон аммония обусловливает
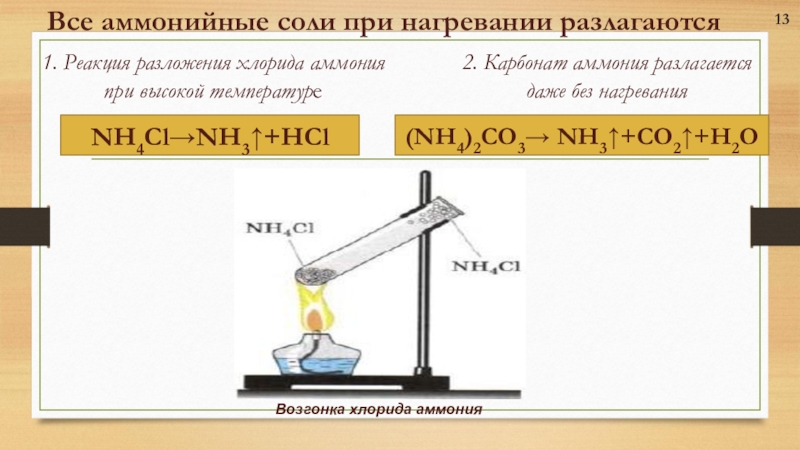
- 13. 1. Реакция разложения хлорида аммония
- 14. Разложение дихромата аммонияNH4Cr 2O7→ Cr 2O3 +
- 15. «Дым без огня»Аммиак взаимодействует с кислотами, образуя
- 16. Задание № 4. Способы получения солей.Соли аммония
- 17. Применение аммиака и солей аммония:1,2 — в
- 18. 181) Гидрокарбонат аммония NH4HCO3 и карбонат аммония
- 19. IV. ЗакрепленияИз предложенных формул веществ составить цепочку
- 20. Подведение итогов 1. Оценка работы учащихся в
- 21. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Цели:
углубить и расширить знания учащихся о солях, образованных сложным катионом
аммония;
познакомить с общими и специфическими свойствами солей аммония;
развивать умения, наблюдать,
делать выводы, обобщать при проведении лабораторных опытов, продолжать развивать умения в записи уравнений реакций в ионном виде;применять теоретические знания для составления прогнозов;
воспитывать умения общаться в коллективе, прививать трудолюбие, умение слушать и слышать, корректировать ответы, брать на себя ответственность за работу каждого члена группы.
Оборудование: твердые соли аммония: хлорид, сульфат, нитрат и их растворы; растворы нитрата серебра, хлориды бария, гидроксид натрия, серной кислоты; лакмусовая бумага. Посуда для проведения опытов.
2
Слайд 3«Химии никоим образом научиться невозможно, не видав самой практики и
не принимаясь за химические операции».
М.В. Ломоносов
«Можно не любить химию,
но прожить без неё сегодня и завтра нельзя» О.М. Нефёдов
Девиз урока
3
Слайд 4
I. Организационный этап.
II. Проверка домашнего задания.
III. Изучение нового материала
4
План
урока
Слайд 5Соли аммония
– соли содержащие сложный ион NH4+,
по строению и по свойствам похожи на соответствующие соли натрия и калия: по знаку и величине заряда и по численному значению радиуса приблизительно равны
R NH4+=0,143 нм, R K+=0,133 нм
Физические свойства: соли аммония – твердые кристаллические вещества, хорошо растворимые в воде.
5
Кристаллическая решетка
NH₄Cl
NH4NO3
нитрат аммония
III. Изучение нового материала
Слайд 6
Состав
Строение
Есть возможность образовать
донорно-акцепторную связь
Молекула образована
ковалентной полярной связью
6
Слайд 7СОЛИ АММОНИЯ
7
(NH4)2SO4
сульфат аммония
(NH4)2HPO4
гидрофосфат аммония
NH4NO3
нитрат аммония
(аммиачная селитра)
NH4HCO3
гидрокарбонат аммония
(NH4)2CO3
карбонат аммония
NH4Cl
хлорид аммония
(нашатырь)
Слайд 8Задание № 1. Обсуждение физических свойств солей аммония.
Каждая группа из
4 (по 6-7 чел.) используя таблицу растворимости солей и проводя
аналогию с соответствующими солями калия выполняет задание (находятся на столах) отвечают на вопросы по образцам выданных соли:1. агрегатное состояние;
2. цвет;
3. отношение к воде.
8
Слайд 9Химические свойства солей аммония
Вспомните правила Т/Б!
9
Вспомните о химических свойствах солей
металлов!
Слайд 10Задание № 2: практическим путем, соблюдая при этом правила техники
безопасности,
подтвердить химические свойства солей аммония.
1-я группа проводит реакцию между
солью и кислотой, с записью уравнения реакции в молекулярном и ионном виде.2-я группа проводит реакцию «соль+щелочь».
3-я группа проводит реакцию «соль+соль».
4-я группа проводит реакцию «соль+соль», используя для реакции нитрат серебра.
По окончанию опыта учащиеся каждой группы записывают уравнения реакций в тетрадях и на доске и делают выводы.
10
Слайд 11Задание № 3. Записать уравнение электролитической диссоциации для солей аммония:
а)
хлорида аммония;
б) нитрата аммония;
в) карбонат аммония;
г) сульфат аммония.
11
а) NH4Cl↔ NH4+
+ Cl-;б) NH4NO3 ↔ NH4+ + NO3-;
в)(NH4)2CO3 ↔ 2NH4+ + CO32;-
г) (NH4)2SO4 ↔ 2NH4+ + SO42-
Слайд 12Качественная реакция на ион аммония
Ион аммония обусловливает общее для всех
солей аммония свойство: его соли реагируют с щелочами при нагревании
с выделением аммиака например:12
NH4+ + OH- ↔ H2O + NH3↑
или в ионном виде:
Демонстрацию данного опыта проводит учитель!
Данные уравнения учащиеся записывают самостоятельно с дальнейшим обсуждением.
Слайд 131. Реакция разложения хлорида аммония при высокой температуре
13
(NH4)2CO3→
NH3↑+CO2↑+H2O
Все аммонийные соли при нагревании разлагаются
2. Карбонат аммония разлагается
даже без нагревания
NH4Cl→NH3↑+HCl
Возгонка хлорида аммония
Слайд 14Разложение дихромата аммония
NH4Cr 2O7→ Cr 2O3 + N2↑+4H2O
14
Демонстрацию данного опыта
проводит учитель с сопровождением материала презентации и комментариями!
Слайд 15«Дым без огня»
Аммиак взаимодействует с кислотами, образуя соли аммония.
Опыт:
стеклянную палочку или стакан, смоченные раствором аммиака, поднести к другой
палочке или стакану, смоченным соляной кислотой, — появится густой белый дым15
Демонстрацию данного опыта проводит учитель с комментариями!
Слайд 16Задание № 4.
Способы получения солей.
Соли аммония получают взаимодействием аммиака или
его водного раствора с кислотами.
1. Нитрофосфатный метод поучения нитрата аммония (способ Одда):
Ca(NO3)2 +
4H3PO4 + 8NH3 CaHPO4 + 2NH4NO3 + 3(NH4)2HPO4 2. По способу Габера из азота и водорода синтезируется аммиак, в результате чего образуется нитрат аммония:
3H2 + N2 2NH3 при давлении, высокой температуре и катализаторе
NH3 + 2O2 HNO3 + H2O
HNO3 + NH3 NH4NO3
16
Учащиеся самостоятельно подготовили материал по способу получения солей, работая с дополнительными источниками.
Слайд 17Применение аммиака и солей аммония:
1,2 — в холодильных установках;
3
— производство минеральных удобрений;
4 — производство азотной кислоты;
5
— для паяния; 6 — получение взрывчатых веществ;
7 — в медицине и в быту (нашатырный спирт)
17
С данным материалом можно ознакомить учащихся на уроке при наличии учебного времени или на самостоятельное изучение.
Слайд 1818
1) Гидрокарбонат аммония NH4HCO3 и карбонат аммония (NH4)2CO3
Будущим хозяйкам на
заметку!
NH4HCO3 NH3 ↑ + H2O + CO2 ↑
Применяют в
кондитерском деле, так как они легко разлагаются при нагревании и образуют газы, разрыхляющие тесто и делающие его пышным, например:С данным материалом можно ознакомить учащихся на уроке при наличии учебного времени или на самостоятельное изучение.
2) Аммиачная селитра (нитрат аммония) – прекрасное азотное удобрение.
Любителям получать высокие урожаи на огороде!
NH4NО3
3) Аммиачная селитра (нитрат аммония) – взрывчатое вещество!
В смеси с порошками алюминия и угля используют в качестве взрывчатого вещества — аммонала, который широко применяют при разработке горных пород.
Осторожно взрывоопасно!
Слайд 19IV. Закрепления
Из предложенных формул веществ составить цепочку превращений:
NH3, NH4OH, N2,
NH4Cl, (NH4)2SO4, NH4NO3.
Дома записать уравнения реакций, согласно этой схеме.
19
Слайд 20Подведение итогов
1. Оценка работы учащихся в группах:
Оценка работы учащихся в
группах лидерами групп и учителем.
а) что узнали нового?
б) интересно или
нет было на уроке?в) что больше всего заинтересовало?
г) кто и почему оставался равнодушным (если такие были)?
д) каждая группа «поет дифирамбы» соли – синквейн, с которой работали.
2. Задание на дом:
учить § 26,
решить задачи № 4, 5;
приготовить информацию о применении солей аммония.
20