Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация для урока в 11 классе,химия 11 класс "Кислоты органические и неорганические"
Содержание
- 1. Презентация для урока в 11 классе,химия 11 класс "Кислоты органические и неорганические"
- 2. Цель: Изучение и закрепление знаний о кислотах
- 3. Кислоты с точки зрения
- 4. ОРГАНИЧЕСКИЕ – ЛИМОННАЯ, ЯБЛОЧНАЯ, УКСУСНАЯ, ЩАВЕЛЕВАЯ, МУРАВЬИНАЯ По происхождению кислоты бывают:
- 5. НЕОРГАНИЧЕСКИЕ- СЕРНАЯ, СОЛЯНАЯ, ПЛАВИКОВАЯ, ФОСФОРНАЯ, АЗОТНАЯ.
- 6. Кислоты в природе
- 7. Соляная кислота, находящаяся в желудке, помогает переваривать
- 8. Классификация кислот: по агрегатному состоянию:
- 9. бескислородные
- 10. По количеству атомов водородаКИСЛОТЫодно-основныеHClHNO3двух-основныеH2SH2SO4трех-основныеH3PO4
- 11. По растворимости в воде:
- 12. По летучести:
- 13. По степени электролитической диссоциации:
- 14. По стабильности:
- 15. Инструкция для выполнения лабораторной работы по группам
- 16. Инструкция для выполнения лабораторной работы по группам
- 17. Инструкция для выполнения лабораторной работы по группам
- 18. Инструкция для выполнения лабораторной работы по группам
- 19. Общие химические свойства органических и неорганических кислот
- 20. 1.В чём проявляется сходство органических и неорганических
- 21. Рефлексия1.
- 22. Задание на домп 22.№1-7
- 23. Скачать презентанцию
Цель: Изучение и закрепление знаний о кислотах и их свойствах. Задачи.Образовательные: выработать представление о наличие общих химических свойств кислот; закрепить умения пользоваться рядом напряжения металлов и таблицей растворимости.Развивающие: выяснить причины общности
Слайды и текст этой презентации
Слайд 2Цель: Изучение и закрепление знаний о кислотах и их свойствах.
Задачи.
Образовательные:
выработать представление о наличие общих химических свойств кислот; закрепить умения
пользоваться рядом напряжения металлов и таблицей растворимости.Развивающие: выяснить причины общности химических свойств кислот;
прогнозировать возможные химические реакции кислот с использованием ряда напряжений металлов и таблицы растворимости; установить закономерности и отработать умения писать уравнения реакций взаимодействия кислот с основаниями, основными оксидами, металлами и солями; отработать навыки работы с лабораторным оборудованием.
Воспитательные: осознание учащимися места неорганических кислот в системе естествознания наряду с организмами; понимание взаимосвязи полученных знаний о химических свойствах кислот с функционированием организма человека, применение в быту.
Оборудование: микролаборатория для химического эксперимента, влажные салфетки, аскорбиновая кислота, лимон,NaOH,Na2CO3,HCl,CaO,Zn, фенолфталеин, индикаторная бумага, пробирки
Слайд 3
Кислоты с точки зрения ТЭД – это
электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного
остатка.
Кислоты сложные вещества состоящие
из атомов водорода и кислотного остатка.
В состав органических кислот входит карбоксильная группа.
Слайд 4ОРГАНИЧЕСКИЕ –
ЛИМОННАЯ, ЯБЛОЧНАЯ, УКСУСНАЯ, ЩАВЕЛЕВАЯ, МУРАВЬИНАЯ
По происхождению
кислоты бывают:
Слайд 7Соляная кислота, находящаяся в желудке, помогает переваривать пищу.
Молочная кислота образуется
в мышцах при физической нагрузке.
КИСЛОТЫ СОДЕРЖАТСЯ В ОРГАНИЗМАХ ЖИВОТНЫХ
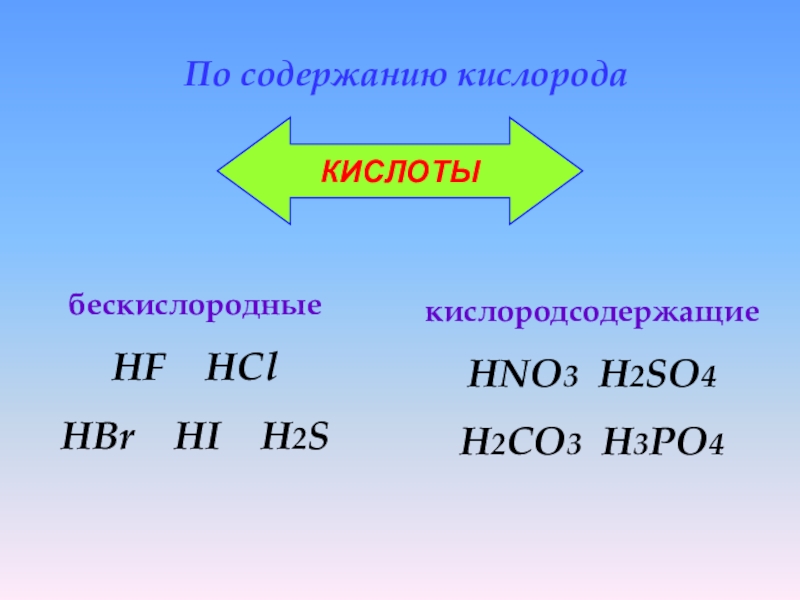
Слайд 9бескислородные
HF
HCl
HBr HI H2S
По содержанию кислорода
кислородсодержащие
HNO3 H2SO4
H2CO3
H3PO4КИСЛОТЫ
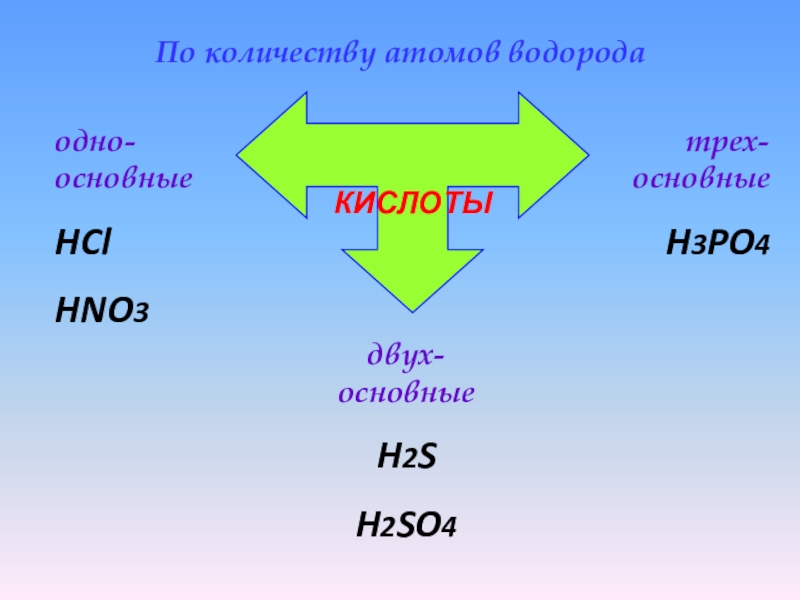
Слайд 10 По количеству атомов водорода
КИСЛОТЫ
одно-основные
HCl
HNO3
двух-основные
H2S
H2SO4
трех-основные
H3PO4
Слайд 15Инструкция для выполнения лабораторной работы по группам
Инструкция к заданию 1
Цель:
сравнить взаимодействие неорганических и органических кислот с металлами.
Оборудование и реактивы:
растворы соляной и уксусной кислот, пробирки, магний, цинк.Возьмите пробирку и налейте в неё 1мл соляной кислоты и поместите туда 1-2 гранулы цинка. Что наблюдаете? Во вторую пробирку поместите 1-2 гранулы цинка и добавьте 1мл уксусной кислоты. Что наблюдаете? Повторите опыте с магнием соляной и уксусной кислотами. Сделайте запись в таблице. Запишите уравнения реакций.
Слайд 16Инструкция для выполнения лабораторной работы по группам
Инструкция к заданию 2
Цель:
сравнить взаимодействие неорганических и органических кислот с оксидами металлов.
Оборудование и
реактивы: растворы соляной и уксусной кислот, пробирки, оксид кальция.В 2 пробирки поместите немного оксида кальция. Прилейте к нему растворы соляной и уксусной кислот. Что наблюдаете? Сделайте соответствующую запись в таблице. Составьте уравнения химических реакций.
Слайд 17Инструкция для выполнения лабораторной работы по группам
Инструкция к заданию 3
Цель:
сравнить взаимодействие неорганических и органических кислот с солями
Оборудование и реактивы:
растворы соляной и уксусной кислот, пробирки, раствор карбоната натрияВ 2 пробирки налейте по 1-2 мл раствора карбоната натрия, затем к нему прилейте растворы соляной и уксусной кислот. Что наблюдаете? Сделайте соответствующую запись в таблице. Составьте уравнения химических реакций.
Слайд 18Инструкция для выполнения лабораторной работы по группам
Инструкция к заданию 4
Цель:
сравнить взаимодействие неорганических и органических кислот с основаниями
Оборудование и
реактивы: растворы соляной и уксусной кислот, пробирки, растворы гидроксида натрия и фенолфталеин.В пробирку налейте 1мл гидроксида натрия, добавьте в него несколько капель фенолфталеина. Что наблюдаете? Затем по каплям прилейте соляной кислоты. Что наблюдаете? Во второй пробирке проведите такую же реакцию с уксусной кислотой. Сделайте соответствующую запись в таблицу
Слайд 201.В чём проявляется сходство органических и неорганических кислот?
2.Чем определяются свойства
органических и неорганических кислот?
3.Как можно определить наличие кислот в продуктах
питания?4.Почему при изжоге медики советуют применять растворы пищевой соды или лекарственные препараты, содержащие карбонат кальция, гидроксиды алюминия или магния?
5.Каково применение кислот в быту? Какие кислоты находят наибольшее применение в быту?