Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Оксиды 11 класс
Содержание
- 1. Оксиды 11 класс
- 2. Что такое оксиды?Оксиды- бинарные соединения с кислородом
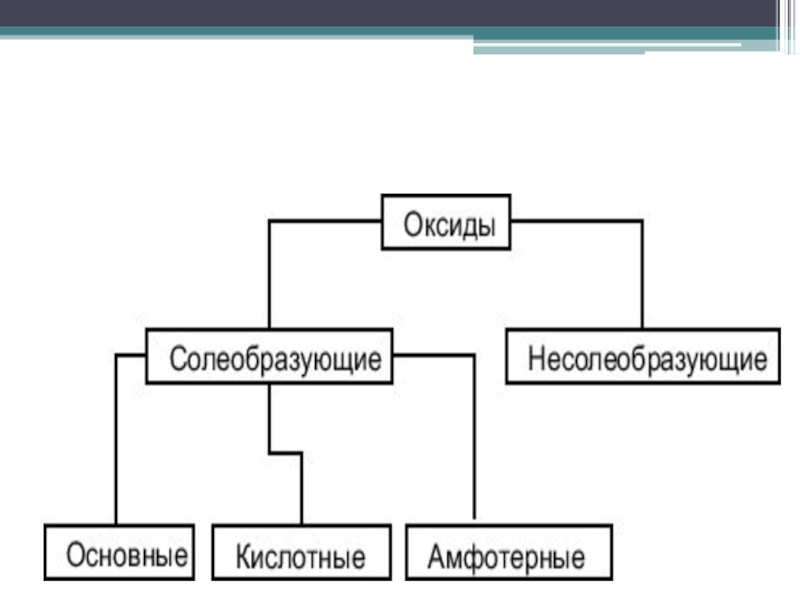
- 3. Классификация оксидов
- 4. Солеобразующие оксидыСолеобразующими называют такие оксиды, которые в
- 5. Несолеобразующие оксидыНесолеобразующими называются такие оксиды, которые не
- 6. Слайд 6
- 7. Кислотными оксидами называются
- 8. Амфотерные оксиды представляют собой оксиды, которые в
- 9. BaO + 2HCl =
- 10. SO3 + H2O =
- 11. ZnO + 2HCl = ZnCl2 +
- 12. Список используемой литературы.1. Габриелян О.С. Программа курса
- 13. Скачать презентанцию
Что такое оксиды?Оксиды- бинарные соединения с кислородом в степени окисления (-2).Общая формула оксидов: ЭmOn где m число атомов элемента Э, а n – число атомов кислорода.
Слайды и текст этой презентации
Слайд 2Что такое оксиды?
Оксиды- бинарные соединения с кислородом в степени окисления
(-2).
Общая формула оксидов: ЭmOn
где m число атомов элемента Э,
а n – число атомов кислорода.
Слайд 4Солеобразующие оксиды
Солеобразующими называют такие оксиды, которые в результате химических реакций
способны образовывать соли.
Солеобразующие оксиды, в свою очередь подразделяются на:
основные, кислотные и амфотерные. Слайд 5Несолеобразующие оксиды
Несолеобразующими называются такие оксиды, которые не взаимодействуют ни со
щелочами, ни с кислотами и не образуют солей. Их немного,
в их состав входят неметаллы.Слайд 6 Основные оксиды
Основными
оксидами называются такие оксиды, которым в качестве гидратов (продуктов присоединения
воды) соответствуют основания.Например: Основные оксиды Соответствующая гидратная форма (основание) Na2O → NaOH BaO→ Ba(OH)2 СaO→ Сa(OH)2
- Какие элементы образуют основные оксиды?
Основные оксиды образуют металлы при проявлении ими невысокой валентности (обычно I или II).
Оксиды таких металлов, как Li,Na, K, Rb, Cs, Fr , Ca , Sr, Ba взаимодействуют с водой с образованием растворимых в воде оснований - щелочей. Другие основные оксиды непосредственно с водой не взаимодействуют, а соответствующие им основания получают из солей (косвенным путем).
Слайд 7
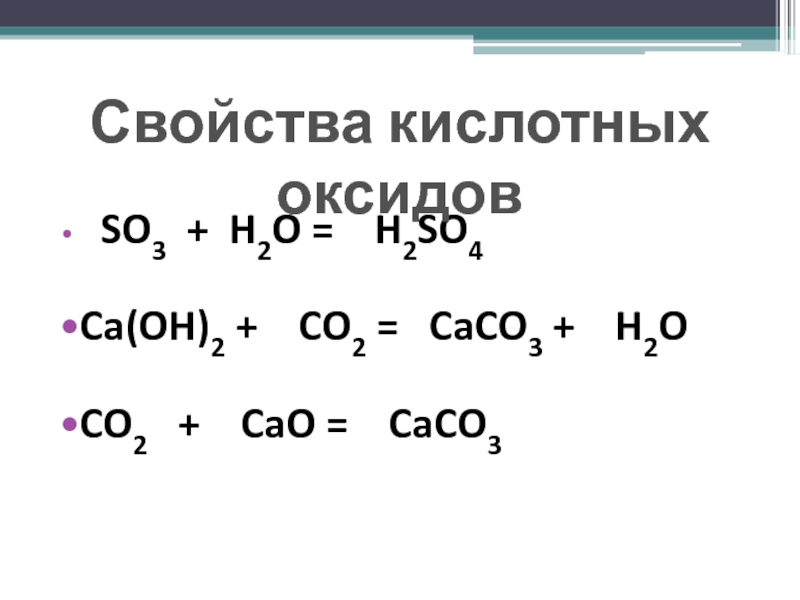
Кислотными оксидами называются такие оксиды, которым
в качестве гидратов соответствуют кислоты. Кислотные оксиды называют также ангидридами
кислот.Например: кислотные оксиды - соответствующая гидратная форма (кислота) SO3 → H2SO4 Р2О5→ H3РO4
- Какие элементы образуют кислотные оксиды?
Кислотные оксиды образуют неметаллы и металлы при проявлений ими высокой валентности. Например, оксид марганца (VII) - кислотный оксид, так как в качестве гидрата ему соответствует кислота HMnO4 и это оксид металла с высокой валентностью.
Большинство кислотных оксидов могут взаимодействовать с водой непосредственно и при этом образовывать кислоты.
Например: СrО3 + H2O → H2CrO4 Р2О5 + H2O → H3РO4 SO3 + H2O → H2SO4
Некоторые оксиды непосредственно с водой не взаимодействуют. Такого типа оксиды сами могут быть получены из кислот. Например:
H2SiO3→ SiO2 + H2O (температура) Это подтверждает названия кислотных оксидов - ангидриды, то есть "не содержащие воду".
Оксиды SO2 и CO2 реагирую с водой обратимо: СО2 + H2O ↔ H2CO3 SО2 + H2O ↔ H2SO3
Кислотные оксиды
Слайд 8
Амфотерные оксиды представляют собой оксиды, которые в зависимости от условий
проявляют свойства как основных (в кислой среде), так и кислотных
(в щелочной среде) оксидов.- Какие элементы образуют амфотерные оксиды?
К амфотерным оксидам относятся только оксиды некоторых металлов.
Например: BeO, Al2O3, PbO, SnO, ZnO, PbO2, SnO2, Сr2О3
Амфотерные оксиды с водой непосредственно не взаимодействуют, следовательно, их гидратные формы получают косвенно - из солей.
Амфотерные оксиды
Слайд 9
BaO + 2HCl = BaCl2 +
H2O
BaO + H2O = Ba(OH)2
CaO
+ CO2 = CaCO3 Na2O + ZnO = Na2ZnO2
Свойства основных оксидов
Слайд 12Список используемой литературы.
1. Габриелян О.С. Программа курса химии для 8-11
классов общеобразовательных учреждений.– М.: Дрофа, 2010г.
2. Габриелян О.С. Химия 8
класс - М.: Дрофа, 2000 г. 3. Габриелян О.С, Лысова Г.Г. Химия 11 класс - М.: Дрофа, 2002 г.
4. Габриелян О.С, Лысова Г.Г, Введенская А.Г. Химия 11 класс: Настольная книга для учителя Часть 1 – М.: Дрофа, 2003 г.
5. Габриелян О.С., Лысова Г.Г., Введенская А. Г. Химия 11 класс: Настольная книга для учителя Часть 2 – М.: Дрофа, 2003 г.
6. Доронькин В.Н., Бережная А.Г. Химия. Подготовка к ЕГЭ. Тематические тесты базового и повышенного уровней - Легион, 2014 г.
7. Мешкова О.В. ЕГЭ. Химия: универсальный справочник - М.: Эксмо, 2010 г.
8. Габриелян О.С., Остроумов И.Г., Сладков. С.А. Химия – М.: Дрофа, 2011 г.