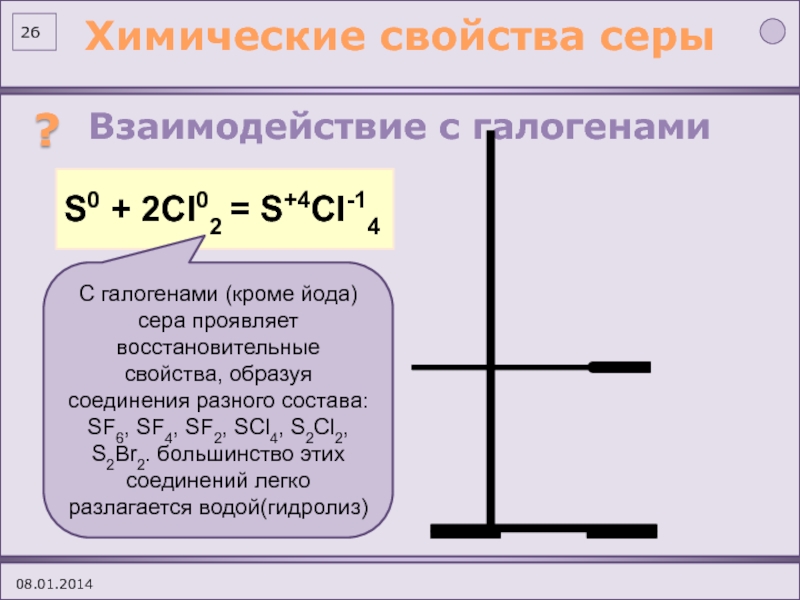
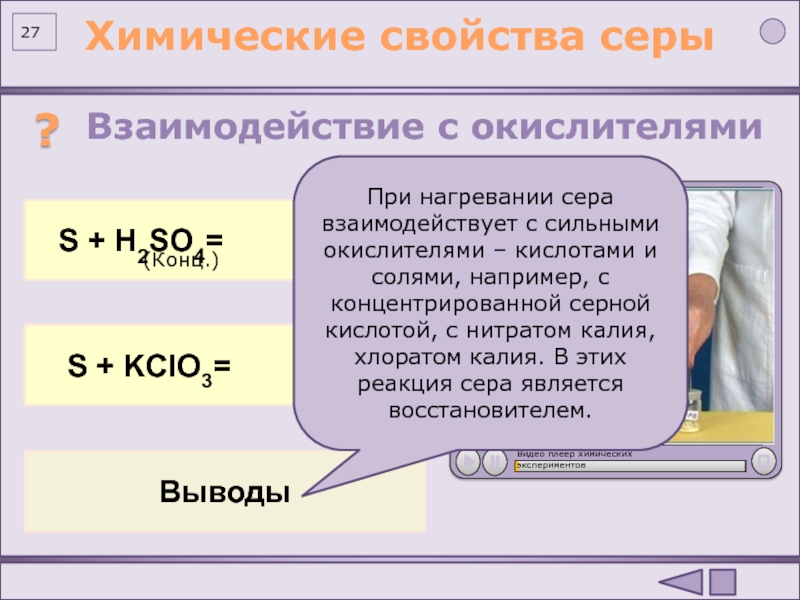
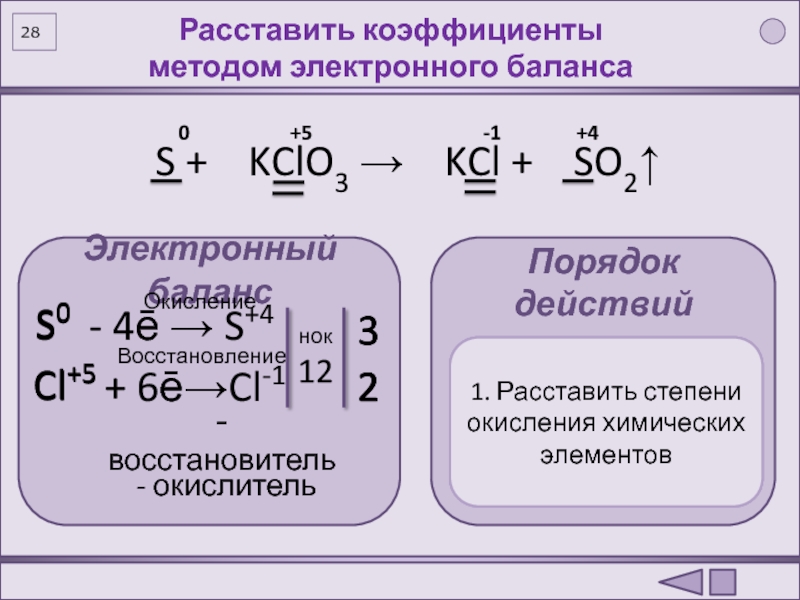
(по
образованию юрист, а по призванию химик)
в своих опытах по сжиганию в 1770 году..
Древнерусское название "сера"
употребляется очень давно. Оно происходит от
санскритского слова "сира", что означает светло-желтый.
Историческая справка
Алхимический символ серы
Антуан Лоран Лавуазье
Химический символ Дальтона
Химический символ Берцелиуса