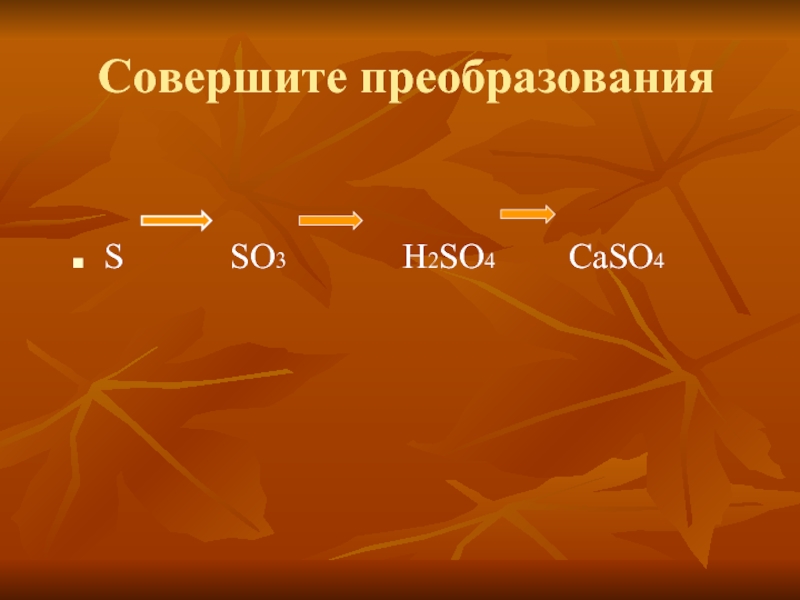
углу ПСХЭ.
Неметаллы характеризуются маленькими радиусами атомов и большим числом электронов
на последнем энергетическом уровне ( валентных электронов). Они с трудом отдают эти электроны и легко принимают чужие. неметаллы