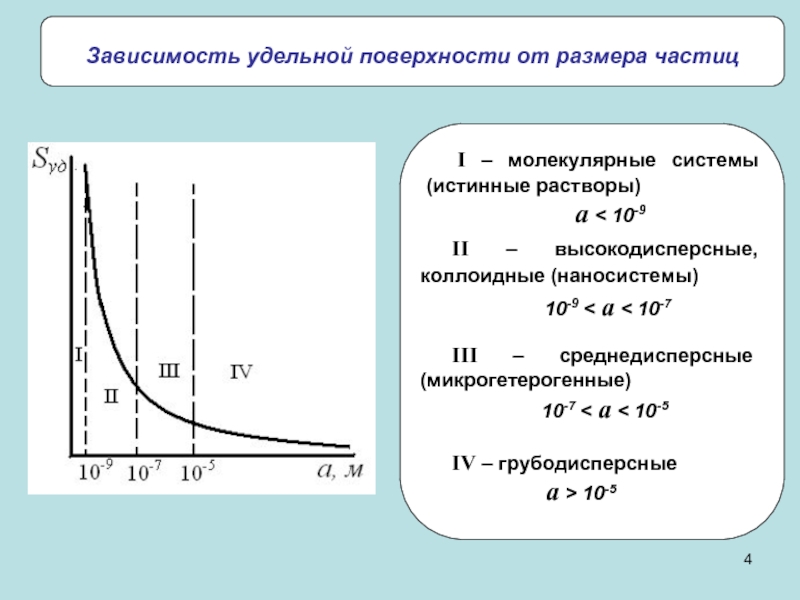
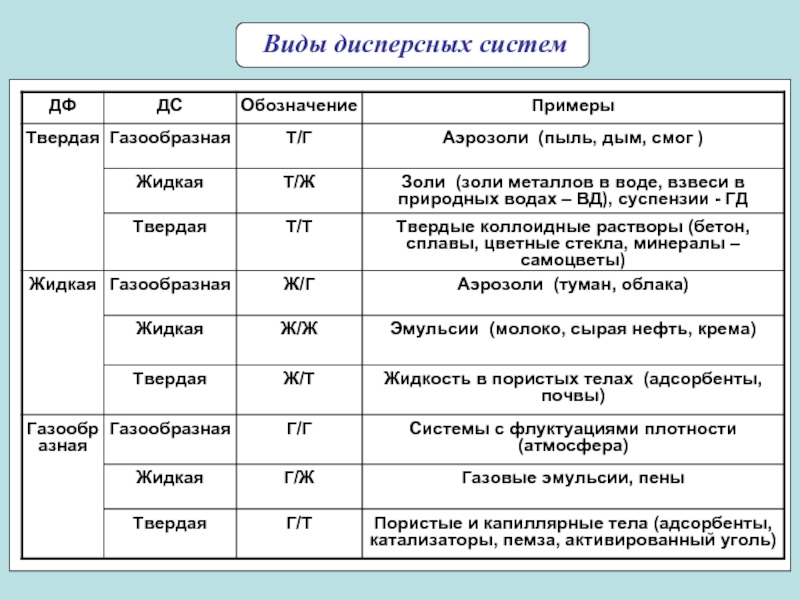
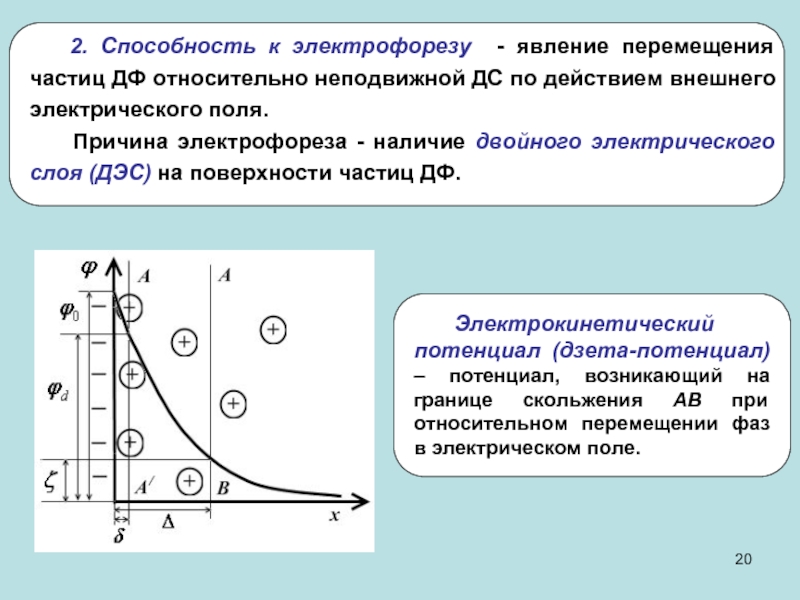
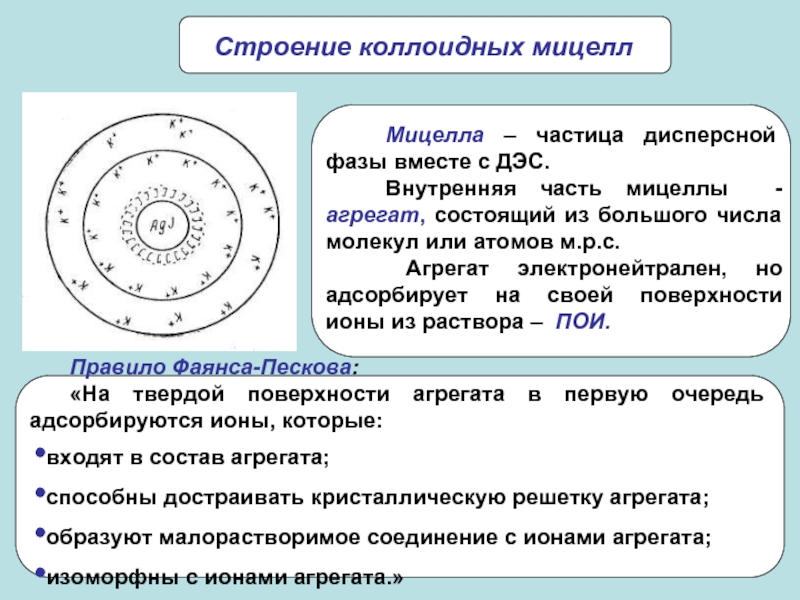
системы)
Дисперсные системы – гетерогенные системы, в которых одна из фаз
находится в дисперсном (раздробленном состоянии). Поверхностные явления – совокупность явлений, связанных с физическими особенностями границ раздела между соприкасающимися фазами.